根据以下叙述,回答(l)~(2)小题。
大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CCl2F2)可在光的作用下分解产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为
O3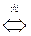 O2+O
O2+O
Cl+O3→ClO+O2
ClO→Cl+O2
总反应:2O3→3O2
(l)在上述臭氧变成氧气的反应过程中Cl是
(A)反应物 (B)生成物
(C)中间产物 (D)催化剂
(2)O3和O2是
(A)同分异构体 (B)同系物
(C)氧的同素异形体 (D)氧的同位素
一定温度下,向a L密闭容器中加入2 mol NO2(g),发生反应:
2NO2 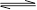 2NO+O2,此反应达到平衡状态时的标志是( )
2NO+O2,此反应达到平衡状态时的标志是( )
| A.混合气体的颜色变浅 |
| B.混合气体的密度不再变化 |
| C.混合气中NO2、NO、O2物质的量之比为2:2:1 |
| D.单位时间内生成2n mol NO,同时生成2n mol NO2 |
已知反应A2(g)+2B2(g)  2AB2(g) △H<0,下列说法正确的是( )
2AB2(g) △H<0,下列说法正确的是( )
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时 间变化的曲线如下图所示。下列描述正确的是( )
间变化的曲线如下图所示。下列描述正确的是( )
| A.反应开始到10 s,用Z表示的反应速 率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s,X的物质的量浓度 减少了0.79 mol·L-1 |
| C.反应开始到10 s,Y的转化率为79.0% |
D.反应的化学方程式X(g)+Y(g)  z (g) z (g) |
几种短周期元素的原子半径及主要化合价如下表()
| 元素代号 |
L |
M |
X |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
下列叙述错误的是
A.R的氧化物对应的水化物可能具有两性 B.X单质在氧气中燃烧不可能生成XO3
C.离子半径大小:r(M3+)>r(T2-)D.最高价氧化物对应水化物碱性:L(OH)2>M(OH)3
NA代表阿伏加德罗常数的数值。下列有关叙述正确的是()
| A.1 mol Cl2与足量的铁反应时转移电子数为3NA | B.3.4g NH3中含N—H键数目为0.2NA |
| C.10g重水含有的质子数为5 NA | D.1mol Na2O2固体中含有的离子总数为4NA |