一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时 间变化的曲线如下图所示。下列描述正确的是( )
间变化的曲线如下图所示。下列描述正确的是( )
| A.反应开始到10 s,用Z表示的反应速 率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s,X的物质的量浓度 减少了0.79 mol·L-1 |
| C.反应开始到10 s,Y的转化率为79.0% |
D.反应的化学方程式X(g)+Y(g)  z (g) z (g) |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是
| A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D.因为Z的氢化物相对分子质量大于X的氢化物,其熔沸点较高 |
对于反应CO(g)+H2O(g) 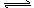 CO2(g)+H2(g) ΔH =-aKJ/mol,在其他条件不变的情况下,下列说法正确的是
CO2(g)+H2(g) ΔH =-aKJ/mol,在其他条件不变的情况下,下列说法正确的是
| A.1mol CO(g)和1molH2O(g)充分反应,放出的热量为aKJ |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,速率加快,反应放出的热量不变 |
| D.若将该反应设计为原电池,反应放出的热量不变 |
对某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生无色无味的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH |
| D.向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中有Cl- |
升高温度时,化学反应速率加快原因的合理解释是
| A.该化学反应的过程是吸热的 |
| B.该化学反应的过程是放热的 |
| C.分子运动速率加快,使反应物分子的碰撞机会增多 |
| D.反应物分子的能量增加,活化分子百分数增加,有效碰撞次数增多 |
短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图所示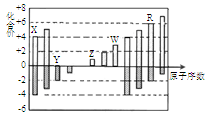
下列说法不正确的是
| A.原子半径:Z>W>Y |
| B.Z和Y形成的化合物是离子化合物 |
| C.气态氢化物的稳定性:R<Y |
| D.常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |