已知H2(g)+Br2(l)="2HBr(g) " △H=-72kJ/mol,蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,其它相关数据如下表:( )
| |
H2(g) |
B r2(g) r2(g) |
HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为
| A.404 | B.260 |
| C.230 | D.200 |
下列离子方程式的书写正确的是
| A.误将洁厕灵与消毒液混合:2H++Cl-+ClO-=Cl2↑+H2O |
| B.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O |
| C.高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+=SO42-+Mn2++2H2O |
| D.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
| A.A12O3、SO2、CO2、SO3 | B.C12、A12O3、N2O5、SO3 |
| C.CO2、C12、CaO、SO3 | D.SiO2、N2O5、CO、C12 |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
| A.CuS的溶解度大于PbS的溶解度 |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |
下列各组物质中,满足右图物质一步转化关系的选项是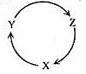
| 选项 |
X |
 Y Y |
Z |
| A |
Na |
NaOH |
NaHCO3 |
| B |
Cu |
CuSO4 |
Cu(OH)2 |
| C |
C |
CO |
CO2 |
| D |
Si |
SiO2 |
H2SiO3 |
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关说法正确的是
| A.反应中NF3是氧化剂,H2O是还原剂 |
| B.反应中被氧化与被还原的原子物质的量之比为2∶1 |
| C.若反应中生成0.2mol HNO3,则反应共转移0.2mol e- |
| D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 |