在0.10 mol·L—1CH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO— +H+ 对于该平衡,下列叙述正确的是( )
CH3COO— +H+ 对于该平衡,下列叙述正确的是( )
| A.加水稀释时,溶液中所有离子的浓度随之减小 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.10 mol·L—1HCl溶液,溶液中c(H+)不变 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
| A.V形;平面三角形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.直线形;三角锥形 |
下列关于配合物的叙述中,不正确的是 ()
| A.配位化合物中必定存在配位键 |
| B.配位化合物中只有配位键 |
| C.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 |
| D.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键 |
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为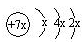 ,b与c形成化合物的电子式
,b与c形成化合物的电子式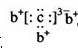 为下列比较中正确的是()
为下列比较中正确的是()
| A.原子半径:a>c>d>b | B.电负性:a>b>d>c |
| C.最高价含氧酸的酸性:c>d>a | D.第一电离能:d>a>b>c |
在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中,正确的是()
原子半径;丙>乙>甲>丁
气态氢经物的稳定性:甲>丙
最高价氧化物对应水化物的酸性:丁>甲
乙和甲或乙和丁所能形成的化合物都是有毒物质
下列叙述正确的是()
| A.同一主族的元素,原子半径越大,其单质的熔点一定越高 |
| B.同一周期元素的原子,半径越小越容易失去电子 |
| C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高 |
| D.稀有气体元素的原子序数越大,其单质的沸点一定越高 |