12mL0.5mol L-1的Na2SO3恰好与l0mL0.2mol-L-1的K2R2O7溶液完全反应,则R元素在还原产物申的化合价为
A,+l B·十2 C.+3 D.+6
实验室中对于少量金属钠的保存方法,正确的是
| A.保存在水中 | B.密封,保存在广口瓶中 |
| C.用铝箔包裹,密封在广口瓶中 | D.密封,保存在煤油中 |
X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是
| A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2 |
| B.Y的氢化物比R的氢化物稳定,熔沸点高 |
| C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z |
| D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成。 |
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH3OH(l)+O2(g)= CO(g)+2H2O(g)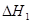 =" -443.64" kJ·mol-1
=" -443.64" kJ·mol-1
2CO(g)+ O2(g)= 2CO2(g)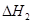 = -566.0kJ·mol-1
= -566.0kJ·mol-1
下列说法或热化学方程式正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
| B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 |
| C.完全燃烧20g甲醇,生成二氧化碳和液态水时放出的热量为908.3 kJ |
D.2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)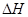 ="-1453.28" kJ·mol-1 ="-1453.28" kJ·mol-1 |
室温下,将0.20mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
| 加入的物质 |
结论 |
|
| A |
100mL 2mol·L-1H2SO4 |
反应结束后,c(Na+)<c(SO42-) |
B |
0.20molCaO |
溶液中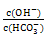 增大 增大 |
| C |
200mL H2O |
由水电离出的c(H+)·c(OH-)不变 |
| D |
0.4molNaHSO4固体 |
反应完全后,溶液pH减小,c(Na+)不变 |
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
| 编号 |
a |
b |
c |
d |
| ① |
Na2O |
Na2O2 |
Na |
NaOH |
| ② |
Al2O3 |
NaAlO2 |
Al |
Al(OH)3 |
| ③ |
FeCl2 |
FeCl3 |
Fe |
CuCl2 |
| ④ |
NO |
NO2 |
N2 |
HNO3 |
A.①② B.②③ C.②④ D.①③