在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。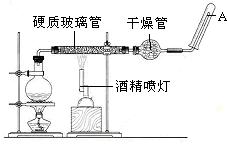
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)实验前必须对整套装置进行气密性检查,操作方法是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)干燥管中盛装是的物质是 ,作用是 。
( 5)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,方法是 。这一操作的目的是 。
(8分)某同学利用如图所示的装置进行有关实验。其中气体A的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题: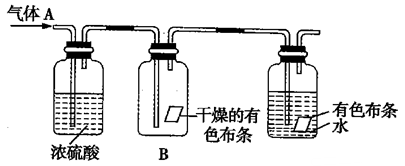
(1)该实验的主要目的是研究干燥的氯气是否具有 作用。
(2)浓硫酸的作用是
(3)实验过程中观察到B瓶中干燥的有色布条 (填“A.退”或“B.不退”)色。
(4)在该实验中,装置存在缺陷,还应加盛有 的装置。
(14分)如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题: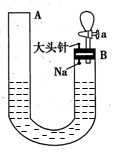
(1)钠与水反应的化学方程式为 。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是 。
②能证明钠的熔点低的现象是 。
③能证明有氢氧化钠生成的现象是 。
④能证明有气体产生的现象是A端液面 (填“A.上升”、“B.下降”或“C.不变”,下同),B端液面 。
⑤钠燃烧产物与H2O反应的化学方程式 。
实验室常用的浓盐酸中溶质的质量分数为36.5%, 密度为1.2g/cm3,.回答下列问题
(1)该浓盐酸中溶质的物质的量浓度为 .
(2)若要配制50mL 该浓盐酸,需要标准状况下HCl的体积为 。
(3)若要配制250mL 1.5mol/L的盐酸,需用量筒量取上述浓盐酸 毫升.
(4)将10ml的3mol/L的盐酸与10ml1mol/L的CaCl2溶液混合,则混合液中Cl-的物质的量浓度是 (假设混合后溶液的体积为二者之和)。
实验室配制500ml0.2mol/L的Na2SO4溶液,实验操作有以下步骤:
a.在托盘天平上称量出14g Na2SO4放于烧杯中加适量蒸馏水溶解并冷却至室温;
b.把制得的溶液小心转移至容量瓶中;
c.继续用烧杯向容量瓶中加水至凹液面与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液都小心注入容量瓶中,并轻轻振荡;
e.将容量瓶瓶塞塞紧,充分摇匀;
f.将所得溶液倒入指定试剂瓶中,贴好标签封存备用。
填写下列空白:
(1)操作步骤的正确顺序是 (填序号)。
(2)本实验用到的基本仪器已有托盘天平(带砝码)、镊子,还缺少的仪器有 。
(3)上述步骤中有明显错误的是 (填序号)。
(4)下列情况会使所配制溶液浓度偏高的是 (填序号):
①定容时俯视;
②定容时仰视;
③没有进行上述操作步骤d;
④加水时不慎超过了刻度线,发现后用胶头滴管吸出;
⑤称量时用的砝码上沾有杂质;
⑥容量瓶使用前没有干燥内壁附有水珠。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,右图为两套实验装置。

(1)写出下列仪器的名称:
①____________;②____________;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 ;图I实验过程中使用冷凝管时应从 处进水(均填序号)。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有 ;将仪器补充完整后进行的实验操作的名称为: 。现需配制500 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是 。