碱式碳酸镁[一般以xMgCO3•yMg(OH)2•zH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应。不溶于乙醇,常温下不会分解,是橡胶制品的优良填料。工艺流程如下图: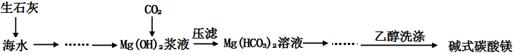
(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是: 。
②氢氧化镁浆液与CO2反应的化学方程式为:
。
③碱式碳酸镁用乙醇洗涤的目的是: 。
(2)已知:碱式碳酸镁分解反应方程式为:
xMgCO3•yMg(OH)2•zH2O 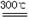 (x+y)MgO+xCO2↑+(y+z)H2O
(x+y)MgO+xCO2↑+(y+z)H2O
某同学将46.6g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为20.0g,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重17.6g。根据实验测定的数据,确定碱式碳酸镁[xMgCO3·yMg(OH)2•zH2O]的化学式(要求写出计算过程)。
研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)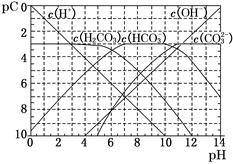
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1 。
。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH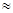 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将。
| A.变大 | B.变小 | C.基本不变 | D.无法判断 |
(2)高温时,用CO还原MgSO4可制备高纯MgO。由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,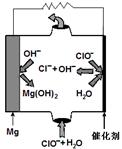
该电池反应的离子方程式为。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H ;
CH3OH(g) +H2O(g) △H ;
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图
所示,则上述CO2转化为甲醇反应热ΔH0(填“>” “<”或“=”)。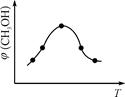
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中各物质浓度相同,且起始时维持反应逆向进行,则c的取值范围为。
过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。已知:2Na2CO3+3H2O2=2Na2CO3·3H2O2 △H<0;回答下列问题:
(1)下列物质可使过碳酸钠较快失效的是(填序号)。
| A.FeCl3溶液 | B.H2S | C.稀硫酸 | D.NaHCO3溶液 |
(2)已知产物C是一种常用氮肥,则其化学式为,
反应①的总反应方程式为。
(3)该生产流程中可循环使用的物质是。
(4)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是 。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用右图所示装置进行有关实验。
请回答: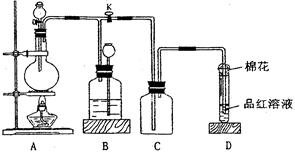
(1) 装置A中发生的化学反应方程式为
_____________________________________。
(2) 装置D中试管口放置的棉花中应浸一种液体,这种液体是 ,其作用是 。
(3) 装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是。
B中应放置的液体是(填字母) 。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4) 实验中,取一定质量的铜片和一定体积18 mol·L—1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
① 有一定量的余酸但未能使铜片完全溶解,你认为原因是。
② 下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.NaOH固体 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
(每空2分,共16分)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH:
CH3CH2CH2CH2OH:
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式: ____________________________________________________________________________。
(2)若用以上装置制备H2,在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓ ;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
试剂1为________,操作1为________,操作2为________,操作3为________。
实验室配制500ml 2mol·L-1的H2SO4溶液
(1)所需仪器应该有容量瓶、玻璃棒、量筒、________________、________________。
(2)容量瓶在使用前,首先应检查。
(3)此实验中,玻璃棒的两个作用分别是________________、________________。
(4)配制时,要用量筒量取密度为1.84g/cm3,质量分数为98%的浓硫酸_____________ml。
(5)若配好摇匀后,发现容量瓶中的液面略低于刻度线,问是否应该补充蒸馏水_________(填“应该”或“不应该”);若所用的容量瓶中事先有少量的蒸馏水,则对实验结果有无影响____________。(填“有影响”或“无影响”)