在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g) 2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为____________mol· L-1·s-1。
(2)计算在80 ℃时该反应的平衡常数K=___________。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色___________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO |
| C.使用高效催化剂 | D.升高温度 |
(5)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线。
同温同压下,若A容器中充满O2 ,B容器中充满O3。
(1)若所含分子总数相等,则A容器和B容器的容积之比是
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是
(3)若两容器的体积比为3∶2,则O2和O3物质的量之比为_________,质量之比为_______,密度之比为______________。
(3分)A元素的原子最外层有3个电子,B元素的原子最外层有7个电子,当它们失去或得到电子形成稳定结构时,A的化合价为________,B的化合价为____ _____,A与B结合形成化合物的化学式为_______________。
_____,A与B结合形成化合物的化学式为_______________。
已知:
(1)该反应的生成物中含有的官能团的名称是__________,该物质在一定条件下能发生_______(填序号)。
①氧化反应②还原反应③酯化反应
(2)已知HCHO分子中所有原子都在同一平面内,若要使R1CHO分子中所有原子可能都在同一平面内,R1可以是________(填序号)。
①—CH3②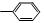 ③—CH═CH2
③—CH═CH2
(3)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:
结构分析表明E分子中含有两个甲基且没有支链。
①写出下列转化的反应类型:
A→B_______________;D→E_________________。
②A、E的结构简式分别为、
③写出A→B的化学方程式_________________
有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示,请回答:
(1)淡黄色粉末为_____________(填名称)。其电子式为_____________
(2)溶液中肯定没有_____________离子。
(3)溶液中离子的物质的量之比为____________________________。
(4)①淡黄色粉末与水反应的化学方程式为__________________,
②沉淀部分减少时的离子方程式为_________________________________。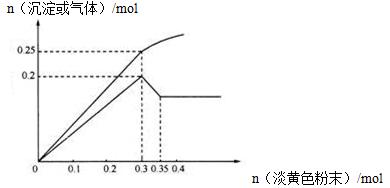
A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。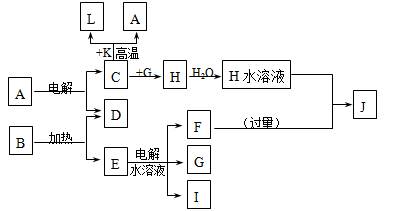
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃);K为红棕色粉末。
请回答:
(1)I在G中燃烧时的现象为________________________________。
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学方程式_____________________________________。
(3)写出C与K反应的化学方程式______________________,引发该反应的操作为______________________________________________。
(4)J与H反应的离子方程式为_________________________________。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为_____________。