实验室配制500mL 0.1mol/L的NaOH溶液,有如下操作步骤:
①计算所需NaOH固体的质量并用托盘天平称取;
②将称量好的NaOH固体放入烧杯中,加入适量的蒸馏水溶解,然后转移至容量瓶中;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;
④继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
⑤塞紧容量瓶的塞子,充分摇匀。
回答下列问题:
(1)容量瓶在使用前,必须
(2)实验中用托盘天平实际称取NaOH固体的质量是
(3)上述实验操作②中,缺少的步骤是
(4)在实验中,未进行操作③,所配溶液的浓度会 (填“偏高”、“偏低”或“无影响”,下同);定容时俯视液面,所配溶液的浓度会 。称量前容量瓶有少量水,所配溶液的浓度会 。
回答下列有关常数的问题
(1)Kw的数学表达式是Kw=,温度升高Kw的变化情况是(选填“变大”、“变
小”或“不变”)。
(2)K通常表示化学平衡常数,K值越大表示该反应进行得越,对于反应2NO2(g)  N2O4(g),其化学平衡常K的数学表达式为
N2O4(g),其化学平衡常K的数学表达式为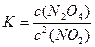 ,式中c2(NO2)表示的意义是。
,式中c2(NO2)表示的意义是。
(3)Ka通常表示弱酸的电离平衡常数,α通常称为电离度。对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Ka的变化情况是(选填“变大”、“变小”或
“不变”),α的变化情况是(选填“变大”、“变小”或“不变”)。
A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C 元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2 型共价化合物和C2A 型离子化合物。由上述条件回答下列问题:
(1) A、B、C三元素的元素符号分别是:A_______,B_______,C_______。
(2) 化合物C2A的电子式是_______(3)化合物BA2的化学式是:_______
写出下列物质或微粒的电子式(每空1分)
(1) CaCl2(2)CO2(3) KOH
(4) HF(5) Na2O2(6) N2
(7) 镁离子(8)硫离子(9)NH4Cl_________ (10) Cl2____________________
下列物质中:(填序号)(每空2分)
(1)互为同分异构体的有(2)互为同素异形体的有 ____
(3)属于同位素的有(4)属于同一种物质的有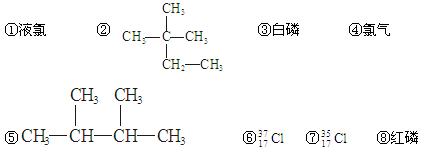
.①MgCl2②干冰③冰④NaCl⑤白磷(P4)⑥SiO2⑦Na2CO3⑧金刚石⑨NaOH (填序号)(每空2分)
(1)属于离子晶体的是(2)属于分子晶体的是
(3)属于原子晶体的是_______(4)熔化时只破坏共价键的是______