我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )
(2)A中常选用的固体反应物为____________;D中应选用的液体为___________ (填化学式)
(3)第二步骤中必须先让________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________________________,C中广口瓶内产生固体的总化学方程式为 。
(5)在第四步中分离NH4Cl晶体的操作是________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分中含有Na+。简要写出操作和现象 。
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题: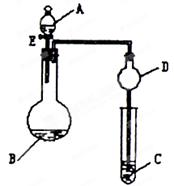
(1)图中D装置在实验中的作用是。
(2)若 A为30%H2O2溶液,B为MnO2,C盛有氢硫酸( H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为
H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为 。
。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3(碘酸为强酸),写出该反应的离子反应方程式。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是,C中发生反应的离子方程式为。
某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaC l2+2H2SO4
l2+2H2SO4 2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。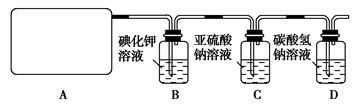
试回答:
(1)该实验中A部分的装置是________(填写装置的序号);
(2)B中反应的化学方程式是。
(3)写出C中反应的离子方程式,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):_ ________________。
________________。
(4)写出在D装置中发生反应的离子方程式。
(5)该实验存在明显的缺陷是__________________________________。
(6)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2===Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 200 mL。则该漂白粉中Ca(ClO)2的质量分数为________。
在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热 水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
⑴ 制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验室制Cl2的化学方程式;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
| A.碱石灰 | B.氢氧化钠溶液 | C.饱和食盐水 | D.浓硫酸 |
⑵如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0. 06 mol。
06 mol。 其主要原因有:①_______________________________________________,
其主要原因有:①_______________________________________________,
②__________________________________________________________________________。
⑶比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①;
②。
反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_______(填写编号字母);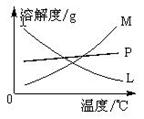
从②的试管中分离出该晶体的方法是__________(填 写实验操作名称)。
写实验操作名称)。
⑷实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
实验 现象 现象 |
原因 |
| 溶液最初从紫色逐渐变为_______色 |
氯气与水反应 生成的H+使石蕊变色 生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
____________________________ __________ __________ |
| 然后溶液从无色逐渐变为_______色 |
______________________ ________________ ________________ |
.已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。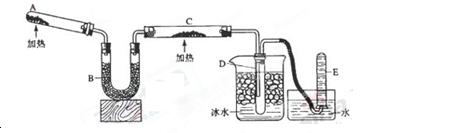
回答下列问题:
(1)A中加入的固态混合物是,发生反应的化学方程式是;
(2)B中加入的物质是,其作用是;
(3)实验时在观察到C中的现象是 ,发生反应的化学方程式是
,发生反应的化学方程式是 ;
;
(4)实验时在D中观察到的现象是,D中收集到的物质是,检验该物质中的某 一种物质的方法和现象是。
一种物质的方法和现象是。
.有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。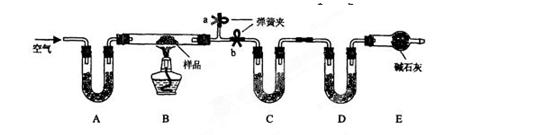
(1)加热前通入空气的目的是 ____________,操作方法为_________________ __。
__。
(2)装置A、C、D中盛放的试剂分别为A___________,C__________,D__________。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将__________(填“偏高”、“偏低”或“无影响”,下同 );若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将___________;若撤去E装置,则测得Na2CO3•10H2O的含量
);若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将___________;若撤去E装置,则测得Na2CO3•10H2O的含量 。
。
(4)若样品质量为 w g,反应后C、D增加的质量分别为 m1 g、m2 g,由此可知混合物中NaHCO3质量分数为_____________________(用含w、m1、m2的代数式表示)。