.有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。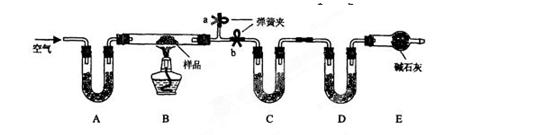
(1)加热前通入空气的目的是 ____________,操作方法为_________________ __。
__。
(2)装置A、C、D中盛放的试剂分别为A___________,C__________,D__________。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将__________(填“偏高”、“偏低”或“无影响”,下同 );若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将___________;若撤去E装置,则测得Na2CO3•10H2O的含量
);若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将___________;若撤去E装置,则测得Na2CO3•10H2O的含量  。
。
(4)若样品质量为 w g,反应后C、D增加的质量分别为 m1 g、m2 g,由此可知混合物中NaHCO3质量分数为_____________________(用含w、m1、m2的代数式表示)。
含苯酚的工业废水的方案如下图所示: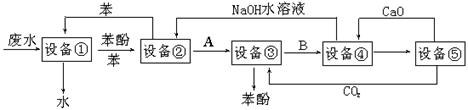
回答下列问题:
⑴设备①进行的是操作(填写操作名称),实验室这一步操作所用的仪器是;下
⑵由设备②进入设备③的物质A是,由设备③进入设备④的物质B是;
⑶在设备③中发生反应的化学方程式为;下
⑷在设备④中,物质B的水溶液和CaO反应,产物是、和水,可通过操作(填写操作名称)分离产物;下
⑸上图中,能循环使用的物质是C6H6、CaO、、
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。请你评价若用上述方法制取乙醛存在哪些不足(写出任意一点):。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
(1)甲装置常常浸在70~80℃的水浴中,目的是;
(2)实验时先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为;反应类型为反应;
②控制鼓气速度的方法是,若鼓气速度过快则会
,若鼓气速度过慢则会;
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在 _____中。
已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化: MnO4-+C2O42-+H+→Mn2++CO2↑+H2O(未配平) MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。试回答下列问题:
⑴配平:MnO4-+C2O42-+H+―Mn2++CO2↑+H2O
⑵0.0200mol·L-1KMnO4标准溶液应置于(选填“甲”或“乙”)滴定管中;判断滴定终点的依据是;
⑶你能否帮助该研究小组求得软锰矿中MnO2的质量分数(选填“能”或“否”)。若回答“能”,请给出计算结果;若回答“否”,试说明原因;
⑷若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是。
| A.滴定前尖嘴部分有一气泡,滴定终点时消失; | B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤; | C.滴定前仰视读数,滴定后俯视读数; | D.定容时,俯视刻度线;E.锥形瓶水洗之后未用待测液润洗。 |
⑴下列实验操作或对实验事实的叙述正确的是(填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“吱吱”的响声;
③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
④向可能含有SO42-、SO32-的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验SO42-的存在;
⑤蒸发NaCl溶液以得到NaCl固体时,不必将溶液蒸干;
⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备Fe(OH)3胶体;
⑦如图,可观察到灵敏检流计的指针偏转;
⑧向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶液的现象相同。
⑵现有0.1mol·L-1的纯碱溶液,用pH试纸测定该溶液的pH,其
正确的操作是
你认为该溶液pH的范围一定介于之间。请你设计一个简单的实验方案证明纯碱溶液呈碱性是由CO32-引起的:。
某学生利用以下装置探究氯气与氨气之间的反应。其中C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体不能选用
| A.生石灰 | B.碱石灰 | C.五氧化二磷 | D.烧碱 |
(2)装置A中发生反应的化学方程式为
(3)B装置的作用;E装置的作用
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式:
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,需要处理,
写出离子方程式
实验室制备氨气,下列方法中适宜选用的是。
①固态氯化铵加热分解②浓氨水中加入固体氢氧化钠
③加热浓氨水④固态氯化铵与氢氧化钙混合加热