实验室欲用NaOH固体配制1.0mol/L的NaOH溶液480mL:
(1)配制时,必须使用的玻璃仪器有________、________、________、________。
(2)要完成本实验该同学应称出NaOH________g。
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
已知在pH为4—5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净CuSO4溶液的方法,并根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验流程如下:

图4-16
试回答下列问题:
(1)步骤①所加入的A的化学式为________________,加入A的作用是___________________,
(2)步骤②中所用部分仪器如图4-16所示,则A应接直流电源的__________极。
(3)电解开始后一段时间,在U形管内可观察到的现象是____________,其电解总反应的离子方程式为________________________。
(4)下列实验操作属必要的是__________(填字母,下同),属不必要的是________________。
| A.称量电解前电极的质量 |
| B.电解后电极在烘干、称量前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上的铜,并清洗、称量 |
| D.电极在烘干称量的操作必须按烘干→称量→再烘干→再称量进行两次 |
E.在有空气存在的情况下,电极烘干必须采用低温烘干法
(5)铜的相对原子质量为______________________。
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:氧化型(蓝色)+ne- 还原型(无色),奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。
还原型(无色),奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。

图1图2
某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2 g NaOH、100 mL H2O和2 g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从____________导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液_________(填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是_________试管。
(3)上述转化过程中葡萄糖的作用是_________,亚甲基蓝的作用是_________。
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为____________________________________。
(5)该实验中③④操作_________(填“能”或“不能”)无限次重复进行,理由是______________。
| A.银镜反应实验后附有银的试管,可用稀H2SO4清洗 |
| B.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次 |
| C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗 |
| D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度 |
E.用10mL的量筒量取4.80mL的浓硫酸
F.不慎接触过多的氨,及时吸人新鲜的空气和水蒸气,并用大量水冲洗眼睛
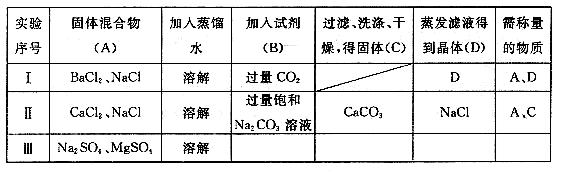
试回答下列问题:
(1)实验Ⅰ中D 的成分是___________称量后_________(填“能”或“不能”)通过计算得到A中各组分的质量比.
(2)实验II 填写的内容中明显错误的是________,其原因________________________
(3)对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内,最终能得出A中各组分的质量比为:(用含字母的表达式表示)____________________________
要除去表中所列有机物中的少量杂质(括号内为杂质),从(Ⅰ)中选择适宜的试剂,从(Ⅱ)中选择分离提纯的方法,用序号填入表中。
(Ⅰ)试剂:a.NaCl固体;b.NaOH溶液;c.生石灰;d.Na2CO3溶液;e.水;f.浓溴水;g.KMnO4溶液
(Ⅱ)方法:
| A.过滤; | B.萃取; | C.蒸馏; | D.分液;E.盐析;F.重结晶 |
| 要提纯物质(杂质) |
CH3CH2Br(CH3CH2OH) |
C2H5OH(H2O) |
肥皂液(甘油) |
C6H5Br(Br2) |
C6H6(C6H5OH) |
| 选用试剂(Ⅰ) |
|||||
| 分离方法(Ⅱ) |