(14分) 实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。 应量取质量分数为36.5%浓盐酸体积________mL,除250mL容量瓶外还需要的其它仪器___________________________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________________.
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为_____________________________________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作___________ ;b.加蒸馏水时不慎超过了刻度______________ ;c.定容时俯视________________。
实验室用电石和水反应制备的乙炔气体中含有少量的H2S气体,为了净化和检验乙炔气体,并通过测定乙炔的体积计算电石的纯度,按下列要求填空(注意X溶液为含溴3.2%的CCl4溶液150 g):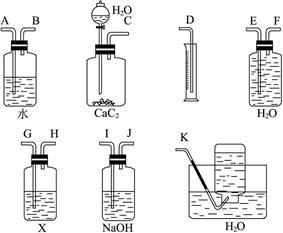
(1)试从图中选用几种必要的装置,把它们连成一套装置,这些被选用的接口编号连接顺序是____________________________________________________________。
(2)实验室能否用启普发生器制乙炔,其原因是______________________________________。
(3)为了得到比较平稳的乙炔气流,常可用_______________代替水。
(4)假设溴的四氯化碳溶液与乙炔完全反应,生成C2H2Br4,用W g的电石与水反应后,测得排入量筒内液体体积为V mL(标准状况下),则此电石纯度计算式为_______________。
(12分)实验室制取乙烯的实验中:
(1)浓H2SO4的作用是_____________________________________________。
(2)浓H2SO4与酒精混合的操作是______________________________。
(3)迅速升温至170 ℃的原因是_____________________________________________。
(4)有效控制反应温度的方法是_____________________________________________。
(5)反应后一阶段的混合液体常变黑,并有刺激性气体生成,除去气体的方法是___________
_______________。
(6)在实验之前,首先应_______________,实验结束时,应先_______________。
如下图,当线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化。完成下列问题: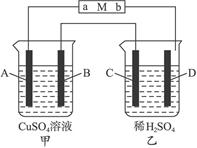
(1)甲、乙分别是什么装置____________、____________。
(2)写出A、B、C、D的电极名称以及电极材料和电极反应式________________________。
电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X电极上的电极反应式为________。在X极附近观察到的现象是________。
②Y电极上的电极反应式为________,检验该电极反应产物的方法是________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是________,电极反应式为________________。
②Y电极的材料是________,电极反应式为________________(说明:杂质发生的电极反应不必写出)。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子形式存在。实验室里从海藻灰中提取碘的流程如图所示。
(1)提取碘的过程中有关操作名称__________________________________。
(2)写出得到碘的离子方程式______________________________________。
(3)提取碘的过程中可以选择的有机试剂是__________________________。
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、导管、圆底烧瓶、石棉网和必要的夹持仪器和物品,尚缺少的玻璃仪器是_______________________。