为了探究可燃物燃烧的条件,按如右图的甲、乙两个装置进行对比实验。请回答:

(1)实验过程中,装置甲热水中的白磷和装置乙薄铜片上的白磷都能够燃烧,而装置乙热水中的白磷未能燃烧,说明,如果停止往装置甲通人氧气,燃着的白磷将会。
(2)装置乙薄铜片上的白磷能够燃烧,红磷未能燃烧,说明可燃物燃烧必须达到燃烧所需的(也叫着火点),红磷的着火点(填"低于"、"等于"或"高于")白磷的着火点。
水是生命之源,也是人类最宝贵的资源。用你学过的化学知识回答下列问题:
(1)(①②每空2分共6分)人类生活和工农业生产都离不开水,下图是自来水厂净化水的过程示意图,请根据图示回答下列问题:
①自来水厂生产自来水时,使用的净水方法有(填序号)。
| A.沉淀 | B.过滤 | C.煮沸 | D.蒸馏 E.吸附 |
②取水后加入絮凝剂(明矾)的作用是。
③小江同学想鉴别家里的自来水是否是硬水,需要向自来水样中加入,来判断。你可以通过(填煮沸或过滤或吸附)的方法帮他把家里的自来水转化为软水
④节约用水人人有责,请举出一种节水的措施 。
(2)(符号表达式2分,共5分)科学家通过研究氢气燃烧和电解水实验认识了水的组成。其中氢气燃烧反应的符号表达式为H2+O2 H2O,该反应类型为。在完成电解水实验时,发现正极产生了10ml气体,则负极产生的气体体积是ml。该反应的符号表达式为。这两个实验共同说明水是由氢元素和氧元素组成的理论依据是。
H2O,该反应类型为。在完成电解水实验时,发现正极产生了10ml气体,则负极产生的气体体积是ml。该反应的符号表达式为。这两个实验共同说明水是由氢元素和氧元素组成的理论依据是。
(1)用相应的化学用语回答:
①两个氢原子,②三个水分子,
③两个氯离子④水通电生成氢气和氧气的反应中的最小粒子和。
(2)下列盛有不同物质的容器中,所盛物质中属于单质的是化合物的是
纯净物的是混合物的是氧化物的是由原子直接构成的是。
(3)各种物质之间存在着某种联系。用 “大于”“小于”或 “等于”填空。
①空气中气体成分的体积分数:氧气氮气;
②地壳中元素含量:铝铁;
③原子中质子数核外电子总数;
④通常状况下的液体体积:100 mL酒精与100 mL水混合200 mL。
(4)(符号表达式2分,共5分)X、Y、Z为初中化学中常见的三种元素.X的单质为密度最小的气体.Y的单质气体能使带火星的木条复燃,Z的原子结构示意图为
请回答下列问题:
①Z元素的名称为.实验室用一种暗紫色固体制取Y单质.该反应的符号表达式是。
②X和Y组成的常见液态化合物与木炭,在髙温下反应生成CO和H2,该反应的符号表达式是。
根据下列实验装置图,回答问题: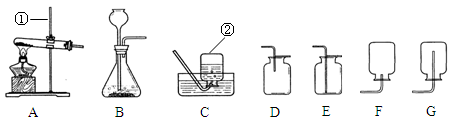
(1)写出装置中带有标号的仪器名称:①____________②_____________。
(2)若用高锰酸钾制取氧气,应选用的发生装置是_________(填“字母”)。收集完气体后发现水槽中的水变红色,原因是__________________________________________________________。
(3)实验室制取O2,如果用排空气法收集,应选用的收集装置是______(填“字母”)
(4)如图所示,检验O2是否收集满的方法是_________________________________。若用排水法收集氧气,则判断集气瓶已集满的方法是______________________________________。
在①铜②水③空气 ④液态氮⑤二氧化硫 ⑥锰酸钾等六种物质中,是混合物的有_________(填序号,下同),是氧化物的有________,是化合物的有________,是金属单质的有__________,是非金属单质的有__________。
氢能是21世纪最理想的能源,但制氢还没有想出真正合适的方法,下图是电解水制氢的简易装置图。
回答下列问题:
(1)电解水实验所用到的电源是(填“直流电”或“交流电”)。
(2)甲管生成____________气体,b应接电源_____________极。
(3)检验乙管中气体的方法是。
(4)理论上甲、乙两试管中气体的体积比为________。
(5)通过以上实验得出的结论是___________________________。