人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
| A.正极反应式:Ag+Cl--e-=AgCl | B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C. Na+不断向“水”电池的负极移动 | D.AgCl是还原产物 |
下列事实不能说明Cl原子的得电子能力比S原子强的是()
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.②⑤ | B.①② | C.①②④ | D.①③⑤ |
下列各组中的性质比较,不正确的是()
| A.稳定性:NH3<PH3<SiH4 |
| B.酸性:HClO4>H2SO4>H3PO4 |
| C.碱性:KOH>NaOH>Mg(OH)2 |
| D.还原性:F-<Cl-<Br- |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是()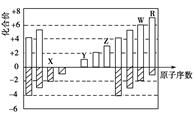
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性R>W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
下列实验不能达到预期目的的是()
| 序号 |
实验操作 |
实验目的 |
| A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
| B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
| C |
测定同浓度的Na2CO3、Na2SO4溶液的pH |
比较碳、硫的非金属性强弱 |
| D |
Fe、Cu分别与盐酸反应 |
比较铁、铜的金属性强弱 |
已知X、Y、Z都是短周期元素,它们的原子序数依次增大,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是()
| A.Y和Z可以组成一种Y和Z的质量比为7∶8的化合物 |
| B.X、Y、Z可以组成一种盐 |
| C.X和Z可以组成原子个数比分别为1∶1和2∶1常温下呈液态的两种化合物 |
| D.由X、Y、Z三种元素中的任意两种组成的10电子微粒有2种 |