下图是N2与H2反应生成NH3的过程中能量变化的曲线图:下列叙述正确的是( )。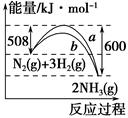
| A.该反应的热化学方程式为 N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
下列各式中属于正确的水解反应离子方程式的是()。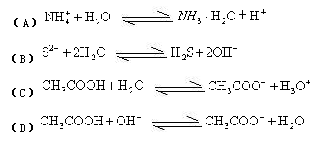
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 + Pb + 2H2SO4 = 2PbSO4↓+ 2H2O,根据此反应判断下列叙述中正确的是()
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb + SO42- - 2e - = PbSO4↓ |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
25℃时,将稀氨水逐滴加入稀盐酸中,当溶液的pH=7时,下列关系不正确的是()
| A.c(NH4+)=c(Cl-) | B.c(H+)=c(OH-) |
| C.c(NH4+)<c(Cl-) | D.c(OH-)+c(Cl-)=c(H+)+(NH4+) |
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是 ( )
| A.氯化铝 | B.碳酸钠 | C.碳酸氢钠 | D.高锰酸钾 |
已知Zn(OH)2的溶度积常数为1.2×10-17(mol·L-1)3,则Zn(OH)2在水中的溶解度为( )
| A.1.4×10-6mol·L-1 | B.2.3×10-6mol·L-1 |
| C.1.4×10-9mol·L-1 | D.2.3×10-9mol·L-1 |