在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为 , , 。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质。以加热处理聚丙烯废塑料为例,实验装置如下左图,处理后得到的产物如下右表。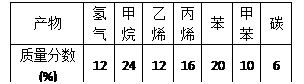
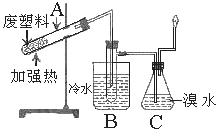
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
写出反应③的化学方程式
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有种。
(3)锥形瓶C中观察到的现象
经溴水充分吸收,剩余气体经干燥后的体积比为(请注明气体)。
(4)写出C中逸出的气体在工业上的两种用途、
某高校曾以下列路线合成药物心舒宁(又名冠心宁),它是一种有机酸盐。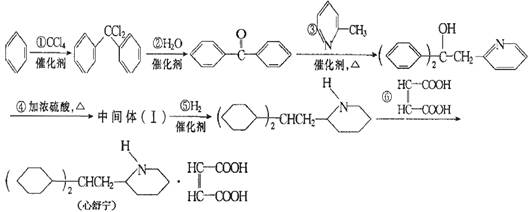
(1)心舒宁的分子式为
(2)中间体(Ⅰ)的结构简式是
(3)反应①~⑤中涉及的有机基本反应类型有(填反应类型名称)。
(4)如果将⑤、⑥两步颠倒,则最后得到的是(写结构简式)
为实现以下各步的转化,请在括号中填入适当的试剂的化学式。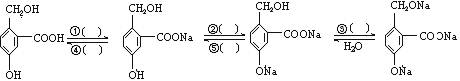
某元素的同位素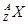 ,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
AgNO3溶液20ml恰好完全反应,若这种同位素原子核内有20个中子,求:
(1)A=
(2)X元素在周期表中的位置?,XCl2的化学式:。
有A,B,C,D,E五种短周期元素,A与B可形成BA型化合物,且A元素是非金属性最强的元素.金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1,C2,C3,自然界里含最多的是C1,C3的质量数是C1的3倍,C2的原子的质量数是C1的2倍.D的气态氢化物的水溶液呈碱性,而其最高价氧化物的水化物为强酸,E元素原子的最外层电子数比次外层电子数多4个,E离子的核外电子数比质子数多2个.
(1)写出元素名称:A.B.C.D.E..
(2)写出C1,C2, C3粒子的符号:,,
(3)写出E离子的结构示意图E的氢化物的分子式.
(4)写出A的单质与B的单质反应的化学方程式;
(5)写出A的单质和B的单质分别与水反应的化学方程式,,将二者反应后生成的溶液混合,发生反应的离子方程式为
(6)A与C形成的化合物中含化学键类型是.用电子式表示该化合物的形成过程.