回答下列问题:
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
或“无法确定”)。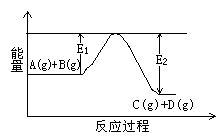
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +34.0" kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2=" —7.0" kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:
I若试管内液面上升,则正极反应: 。
II若试管内液面下降,则发生 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在 (填“甲”或“乙”)溶液中腐蚀的速度快。
【化学选修3:物质结构与性质】
(1)美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型。多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 。
A、NO2-和NH4+ B、H3O+和ClO3- C、NO3-和CO32-D、PO43-和SO42-
(2)铜、锌两种元素的第一电离能、第二电离能如表所示
| 电离能/kJ·mol-1 |
I1 |
I2 |
| 铜 |
746 |
1958 |
| 锌 |
906 |
1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 。
(3)石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体。其结构如图: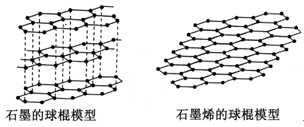
有关说法正确的是
A、固态时,碳的各种单质的晶体类型相同 B、石墨烯中含有非极性共价键
C、从石墨中剥离石墨烯需要破坏化学键 D、石墨烯具有导电性
(4)最近科学家成功以CO2为原料制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以4个共价单键与氧原子结合为一种空间网状的无限延伸结构,则该晶体中碳原子采用 杂化与周围氧原子成键;晶体中碳氧原子个数比为 ;碳原子数与C-O化学键数之比为 。
(5)已知钼(Mo)的晶胞为体心立方晶胞,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏伽德罗常数的值,请写出金属钼密度的计算表达式 g/cm3。
【化学选修2: 化学与技术】
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹。
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 。
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
①净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
②在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度 ;体系中要通入适量的氢气是为了 。
③X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)工业上可以通过如下图所示的流程制取纯硅: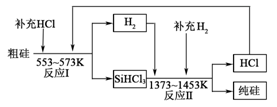
①整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应,写出该反应的化学方程式 。
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%。则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用。
(1)请写出工业上由NH3制取NO的化学方程式 。
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+ CO2(g) FeO(s)+ CO(g),已知该反应的平衡常数K与温度T的关系如图所示。
FeO(s)+ CO(g),已知该反应的平衡常数K与温度T的关系如图所示。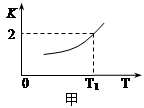
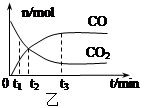
①该反应的逆反应是 (填“吸热”或“放热”)反应。
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是 。
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)= v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示。则CO2的平衡转化率为 ,平衡时混合气体的密度与起始时气体的密度之比为 。
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特定见下表。
2NH3,有关数据及平衡状态特定见下表。
| 容器 |
起始投入 |
达平衡时 |
|||
| 甲 |
2 mol N2 |
3 mol H2 |
0mol NH3 |
1.5mol NH3 |
同种物质的体积分数相同 |
| 乙 |
a mol N2 |
b mol H2 |
0mol NH3 |
1.2mol NH3 |
起始时乙容器中的压强是甲容器的 倍。
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量。生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 倍。请写出该反应的热化学方程式 。
倍。请写出该反应的热化学方程式 。
某晶体(结晶水合物)由五种短周期元素组成。常温下,将该晶体溶于蒸馏水后可电离出三种离子(忽略水的电离),其中两种离子含有的电子数均为10个。将该溶液分成等量2份,一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀;向另一份中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。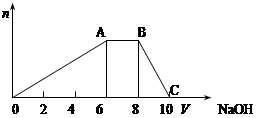
请回答下列问题:
(1)若该晶体的摩尔质量为906g·mol-1,写出该晶体的化学式 ;
(2)B点溶液的pH 7(填“<”、“>”或“=”),用化学用语表示其原因 。
(3)若向该晶体的水溶液中逐滴加入Ba(OH)2溶液至产生最多的沉淀,写出该变化的离子方程式 。
(4)C点溶液中所含溶质的化学式为 ;此时溶液中各种离子浓度由大到小顺序为 。
[化学——选修3:物质结构与性质]
下图分别是金刚石、石墨、足球烯和碳纳米管的结构示意图。图中小黑点或小黑圈均代表碳原子。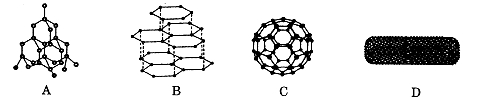
(1)四种物质互称为 。写出碳原子的基态电子排布图 。
(2)试比较:第一电离能I1(C)、I1(N)、I1(O)由大到小的顺序为 。
(3)石墨中存在的作用力有 。
A. 共价键 B. 金属键 C. 氢键
D. 配位键 E. 分子间作用力
石墨中碳原子采取的杂化方式是 。
(4)C的熔沸点比A (填“高”或“低”)原因是 。
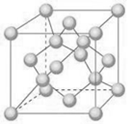
(5)金刚石晶胞结构如下图所示,若金刚石的密度为ρ g·cm-3,试计算碳原子的半径为 pm(用含ρ式子表示,不必化简)。