下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答 下列问题:
下列问题:
| ① |
|
|
|||||||||||||||
| |
|
|
|
② |
③ |
④ |
⑤ |
|
|||||||||
| ⑥ |
来 |
⑦ |
|
|
⑧ |
⑨ |
|
||||||||||
| |
|
|
|
|
|
|
|
|
|
|
|
|
⑩ |
|
|
|
|
(1)元素③形成的单质的电子式为 ;元素②形成的最高价氧化物的结构式为 。
(2)②、③、④、⑤元素形成的氢化物中,热稳定性最强 的是
的是  (填化学式),沸点最高的是 (填化学式)。
(填化学式),沸点最高的是 (填化学式)。
(3)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较 > (填化学式)。
(4)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为 。
(5)元素⑩在周期表中的位置 ;
( 14分)用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求: 
①工作一段时间后A槽pH值上升,B槽的pH下降.②b、c两极上反应的离子的物质的量相等
(1)应选择的电解质是上述四组中的第____组
(2)该组电解过程中各电极上的电极反应式为:
a极______ b极__________
c极__________ d极___________
(3)当b极上析出7.1g电解产物时,a极上析出产物的质量为____g;若B槽电解质溶液500mL,且忽略电解前后电解液的体积变化,则此时B槽中的c(H+)比电解前增加了____mol/L.
已知在0.1 mol/L的NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na+)>c(HSO)>c(SO)>c(H2SO3)。
(1)则该溶液中c(H+)________c(OH-)(填“<”、“>”或“=”),简述理由(用离子方程式和必要的文字说明)________________ ____________________________________
____________________。
(2)现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是________________________________________________________________________;
写出该反应的离子方程式______________________________________
明矾水溶液呈____性,原因是___;(用离子方程式说明)。碳酸钠水溶液呈____性,原因是___.(用离子方程式说明)。把上述两溶液混合后呈现的现象有_,反应现象的离子方程式是.
某同学利用铁与水蒸气反应后的固体物质进行了如下实验:
(1)固体溶于稀盐酸的化学方程为。
(2)试剂1的化学式是。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设:
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:;
②设计方案:
为了对你所提出的假设2进行验证,实验方案是
③方案实施。
(8分)已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引。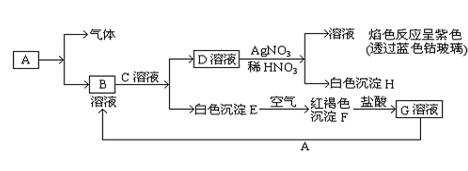
(1)试回答: 写出B的化学式H的化学式。
⑵ 写出由E转变成F的化学方程式。
⑶向G溶液加入A的有关离子反应方程式____。