若用12 mol•L-1的浓盐酸配制0.10 mol•L-1的稀盐酸500 mL,回答下列问题:
(1)量取浓盐酸的体积为 mL,如果实验室有5mL、10mL、50mL量筒,应选用 mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。
(2)配制时应选用的容量瓶规格为 mL ,除容量瓶还需选用的仪器主要有 、 、 和 。
(3)配制时,将量取的浓盐酸沿烧杯内壁慢慢注入约100mL水里,并不断搅拌,目的是 。
(4)将冷却后的上述溶液沿 注入 中,并用约50mL蒸馏水洗涤烧杯2~3次,转移摇匀。(填仪器)
(5)加水至距刻度线  处,改用 (填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。
处,改用 (填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。
(6)若实验遇下列情况,溶液的浓度是偏高 ,偏低还是不变?
,偏低还是不变?
| A.加水时越过刻度线______ | B.忘记将洗涤液加入容量瓶______ |
C.容量瓶内壁附有水珠而未干燥处理 |
D.溶解后没有冷却便进行定容 |
某无色溶液由Mg2+、Al3+、Cl-、NH4+、SO42-中的若干种离子组成。按以下步骤进行实验:
(1)取原溶液少量于试管中,向试管中不断加入氢氧化钠溶液至过量,有白色沉淀生成而后又完全消失,说明原溶液中一定含有的离子是(填相应离子符号,下同)。
(2)取实验①后的溶液于另一试管中,加热,用湿润的红色石蕊试纸置于试管口,结果试纸变蓝,说明原溶液中一定含有的离子是。
(3)取原溶液加入少量盐酸使溶液酸化,再加入氯化钡溶液,产生白色沉淀,说明原溶液中一定含有的离子是。
(4)取实验③的溶液加入少量,加入硝酸银溶液,产生白色沉淀,能否说明原溶液中一定含有的Cl-离子(是或否)。若要检测Cl-离子是否存在,正确的操作是(若前一格填是,这一格不填)。
某化学小组以苯甲酸( )为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
)为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
64.7 |
249 |
199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸(M=122g/mol)和20ml甲醇(密度约0.79g·mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式;浓硫酸的作用是:。
(2)甲、乙、丙三位同学分别设计了如下图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用装置(填“甲”或“乙”或“丙”)。
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ操作Ⅱ。
(4)能否用NaOH溶液代替饱和碳酸钠溶液?(填“能”或“否”),并简述原因。
(5)通过计算,苯甲酸甲酯的产率是。
(14分,每空2分) 硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)=FeSO4+H2↑、FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为 1。
1。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为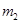 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为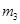 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是(填字母)。
| A.纯碱溶液 | B.烧碱溶液 | C.明矾溶液 | D.稀硫酸 |
(2)步骤2中趁热过滤的目的是。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为。
(4)铁屑表面常有少量的铁锈(Fe2O3·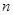 H2O),对FeSO4的制备(填“有”、“无”)影响,理由是(用离子方程式回答)。
H2O),对FeSO4的制备(填“有”、“无”)影响,理由是(用离子方程式回答)。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组测定某葡萄酒中SO2含量。步骤如下:
(1)取300.00 mL葡萄酒,加入适量盐酸,加热使SO2全部逸出
(2)逸出的SO2被稍过量的H2O2完全吸收氧化
(3)加热(2)中溶液,除尽过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,以酚酞为指示剂,滴定到终点,记录消耗NaOH溶液的体积
(4)重复上述操作2~3次
试回答:(1)步骤2中H2O2氧化SO2的化学方程式为__________________________。
(2)NaOH标准溶液用滴定管(填“碱式或酸式”)盛装。
(3)到达滴定终点时,溶液由色变为________色,且半分钟内不再变化;
(4)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处,则管内液体的体积(填序号)________(①=10.00 mL,②=40.00 mL,③<10.00 mL,④>40.00 mL)。
(5)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为______g·L-1
(6)以下操作使所测得的SO2含量偏高的是
A.滴定前,未用NaOH标准溶液润洗滴定管
B.滴定前滴定管内无气泡,终点读数时有气泡
C.滴定前仰视读数,滴定终点时读数正确
某化学兴趣小组,拟探究和比较SO2和C12的漂白性,设计如下图所示的实验装置二套。请你参与探究并回答下列问题。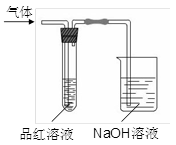
(1)向第一套装置中通入一段时间的SO2,观察到试管中的品红溶液褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
(2)向第二套装置中通入一段时间的C12,观察到试管中的品红溶液也褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
(3)由以上两个实验可以说明SO2和C12的漂白原理(填“相同”或“不相同”);
(4)C12通入品红溶液中,生成的具有漂白性的物质是(填“HC1”或“HClO”)。