中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组测定某葡萄酒中SO2含量。步骤如下:
(1)取300.00 mL葡萄酒,加入适量盐酸,加热使SO2全部逸出
(2)逸出的SO2被稍过量的H2O2完全吸收氧化
(3)加热(2)中溶液,除尽过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,以酚酞为指示剂,滴定到终点,记录消耗NaOH溶液的体积
(4)重复上述操作2~3次
试回答:(1)步骤2中H2O2氧化SO2的化学方程式为__________________________。
(2)NaOH标准溶液用 滴定管(填“碱式或酸式”)盛装。
(3)到达滴定终点时,溶液由 色变为_____ ___色,且半分钟内不再变化;
(4)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处,则管内液体的体积(填序号)________(①=10.00 mL,②=40.00 mL,③<10.00 mL,④>40.00 mL)。
(5)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为______g·L-1
(6)以下操作使所测得的SO2含量偏高的是
A.滴定前,未用NaOH标准溶液润洗滴定管
B.滴定前滴定管内无气泡,终点读数时有气泡
C.滴定前仰视读数,滴定终点时读数正确
(10分)实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
(1)装置中X仪器的名称是:;
碎瓷片的作用是:。
(2)写出生成乙烯的化学反应方程式:。
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号):
①品 红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
A.;B.;C.;D.。
(4)能说明SO2气体存在的现象是。
(5)确证含有乙烯的现象是。
(8分)请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及分离方法的编号填入表中。
试 剂: a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO
分离方法:①.分液②.过滤③.洗气④.蒸馏
| 混合物 |
需加入的试剂 |
分离方法 |
| 溴苯(溴) |
||
| 乙烷(乙烯) |
||
| 乙醇(水) |
||
| 乙酸乙酯(乙酸) |
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题:湖北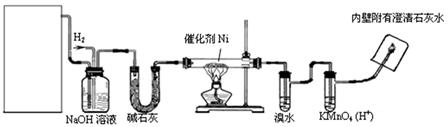
(1)方框内装置用来制取乙烯,现有下列仪器及用品:①碎瓷片②石棉网和铁架台③圆底烧瓶④温度计(量程100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞⑧双孔塞⑨导管。
其中不需用的仪器及用品有(填序号)湖北
(2)写出制乙烯化学方程式:
(3)碱石灰的作用是:
(4)溴水的作用是:
(5)出现什么现象可说明生成了乙烷?
为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为;
(4)当D中产生(多选不得分)现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
装置D的作用为
发生反应用化学方程式可表示为。
实验室制得的氯气通常含有水蒸气和盐酸挥发的氯化氢,要制取干燥纯净的氯气,可用如图所示的装置,进行干燥、净化、收集和尾气处理(C瓶用于收集氯气,D瓶用于尾气处理)。
据此完成下列各题:
(1)实验室通常用饱和食盐水吸收杂质HCl,则图(1)中A瓶和B瓶依次分别盛装的试剂是:_____________________________________;
(2)图(2)是氯气的收集装置,将它安置在图(1)中的虚线框内,其导管的连接顺序是:______________________________;
(3)检查最终尾气排放(导管口c处)是否含有氯气,可用湿润的淀粉-KI试纸测试,如有氯气泄漏,可观察到__________________________________,产生此现象的直接原因是__________________________________;此方法检测氯气,试纸必须用水润湿是因为________________________________________。