实验室制得的氯气通常含有水蒸气和盐酸挥发的氯化氢,要制取干燥纯净的氯气,可用如图所示的装置,进行干燥、净化、收集和尾气处理(C瓶用于收集氯气,D瓶用于尾气处理)。
据此完成下列各题:
(1)实验室通常用饱和食盐水吸收杂质HCl,则图(1)中A瓶和B瓶依次分别盛装的试剂是:_____________________________________;
(2)图(2)是氯气的收集装置,将它安置在图(1)中的虚线框内,其导管的连接顺序是:______________________________;
(3)检查最终尾气排放(导管口c处)是否含有氯气,可用湿润的淀粉-KI试纸测试,如有氯气泄漏,可观察到__________________________________,产生此现象的直接原因是__________________________________;此方法检测氯气,试纸必须用水润湿是因为________________________________________。
已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3  Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。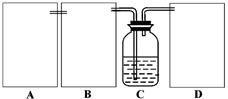
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下装置(填序号)。简述该装置能随关随停的理由。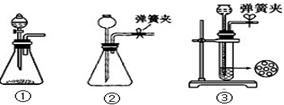
(2)为使实验能够进行,在B、D方框内补上所需装置:(将装置图画在答题卡上),并指明所用试剂:。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为。
(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容、充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察________。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由________色变成______色。
(2)滴定结果如下表所示:
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.101 0 mol·L-1,则该样品中氮的质量分数为________。
(9分)如图是某同学设计的放热反应的观察装置。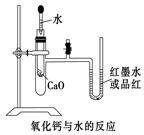
其实验顺序是:①按图所示将实验装置连接好。
②在U形管内加入少量红墨水(或品红)溶液。打开T型管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:(1)实验中观察到的现象是
(2)该实验中必须进行的一步实验操作是
(3)该实验的原理是
________________________________________________________________________
(4)实验中反应的化学反应方程式是
(5)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系
(6)若该实验中CaO换成NaCl,实验还能否观察到相同现象?____。
下列图示是学生课外活动小组设计的制取氨气并进行氨气溶于水的喷泉实验等实验的装置示意图。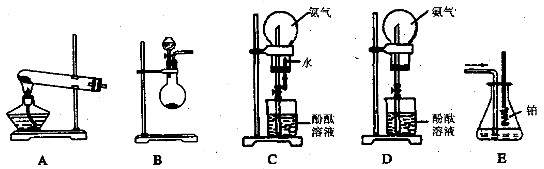
请回答下列问题:
(1)学生甲用图A所示装置制备氨气,写出该法制取氨气的化学方程式____ __________;
__________;
制出的氨气应使用__________________法来收集,要得到干燥的氨气可选用 ________做干燥剂。
(2)学生乙用图B所示装置也制出了氨气,他选用的制取试剂可能是______和________。
(3)学生丙用图C所示装置进行喷泉实验,上部烧瓶已充满干燥 氨气,引发水上喷的操作是:____________________________________________________________。
氨气,引发水上喷的操作是:____________________________________________________________。
(4)学生丁将装置C误装为装置D,但经同学讨论后,认为也可引发喷泉。请说明用该装置引发喷泉的方法:________________________________
(5)学生戊用装置E吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入戊装置的锥形瓶内,看到了具有催化作用的铂丝保持红热,同时瓶内生成了红棕色的气体。写出在此过程中可能发生反应的化学方程式:_____________________________。
。
(1)实验室若要配制220mL,1mol/L的稀硫酸应选用的容量瓶规格是:_______;当定容时,视线偏低,则配得的溶液溶质物质的量浓度_____1mol/L(填“﹥”“=”、“﹤”)
(2)下列有关实验操作的说法正确的是_______
| A.可用25mL碱式滴定管量取20.00mLKMnO4溶液 |
| B.用PH试纸测定溶液的PH时,需先用蒸馏水润湿试纸 |
| C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干 |
| D.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
E.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应