下列判断错误的是
A.沸点: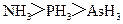 B
B .熔点:
.熔点: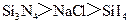
C.酸性: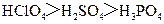 C.碱性:
C.碱性:
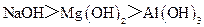
将1.00 mol·L-1NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。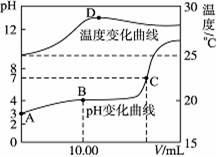
下列说法正确的是
| A.室温时,HA的电离度约为10-6 |
| B.图中B点时,溶液的KW略大于1×10-14 |
| C.图中C点时,溶液中c(A-)=c(Na+)>c(H+)=c(OH-) |
| D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热 |
利用人工模拟光合作用合成甲酸的原理为:
2CO2+2H2O 2HCOOH+O2,装置如图所示,
2HCOOH+O2,装置如图所示,
下列说法不正确的是
| A.电极1周围pH增大 |
| B.电子由电极1经过负载流向电极2 |
| C.电极2的反应式:CO2+2H++2e-=HCOOH |
| D.该装置能将太阳能转化为化学能和电能 |
下列说法正确的是
| A.最简式为C2H4O的有机物一定可以发生银镜反应 |
| B.不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 |
| C.分子结构中含有4个甲基、碳原子数最少的烷烃的系统命名为:2,2-二甲基丙烷 |
| D.甘油和甲苯只有在物质的量之比1︰1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同 |
A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素。下列说法不正确的是
| B |
C |
| D |
A.简单离子的半径大小关系:B>C>E
B.D、E两种元素形成的化合物,可能含有离子键和共价键
C.A、B、C三种元素形成的化合物,晶体类型一定相同
D.B、D分别和C形成的化合物,都有可能使溴水或品红溶液褪色
下列关于实验操作或设计的说法正确的是
| A.乙酸与乙酸乙酯的混合物,可通过蒸馏或用足量饱和碳酸钠溶液洗涤后分液的方法进行分离 |
| B.做金属钠和水反应实验时,切割下来的表层物质,也不能直接丢弃到废纸篓里,而应放回原试剂瓶 |
| C.酸式滴定管在润洗时,可在滴定管中加入少量待装液,润洗后将溶液从滴定管的上口倒入废液缸中,重复2~3次,润洗完毕 |
| D.高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |