已知:CH4(g)+2O2(g)==CO2(g)+2H2O (l) △H= ―Q1KJ・mol-1
2H2(g)+O2(g)==2H2O(g) △H = ―Q2KJ・mol-1
2H2(g)+O2(g)==2H2O(l) △H = ―Q3KJ・mol-1
常温下,取体积比为4 :1的甲烷和氢气的混合气体11 .2L(标准状况),经完全燃烧后恢复到到常温,放出的热量(单位:KJ)为
| A.0.4Q1+0.05Q3 | B.0.4Q1+0.05Q2 |
| C.0.4Q1+0.1Q3 | D.0.4Q1+0.2Q3 |
某同学用下列装置制备并检验Cl2的性质。下列说法错误的是
A.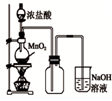 如图中: MnO2过量,盐酸能全部消耗 |
B.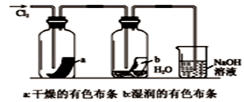 如图中:湿润的有色布条能褪色 |
C.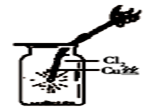 如图中:生成棕色的烟 |
D.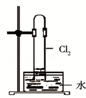 |
如图中:水可以充满试管
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法错误的是
| A.溶液中Na+数目减少,有固体析出 |
| B.溶液中Na+数目减少,有气体逸出 |
| C.溶液中H2O数目减少,溶质的质量分数增大 |
| D.溶液中H2O数目减少,溶质的质量分数未变 |
利用N2→NH3→NO→NO2→HNO3这一过程制备HNO3,有关上述各物质的叙述不正确的是
| A.工业固氮的常用方法是N2和H2合成NH3 |
| B.可利用Cu与硝酸的反应,将N元素转化为NO或NO2 |
| C.为使上述各步骤依次发生,必须向每个步骤中提供氧化剂 |
| D.实验室可利用氢氧化钙固体与NH4Cl固体混合加热制备NH3 |
向下列各个反应产物的溶液中加入硫氰化钾试液,不会出现血红色的是
| A.Fe+Cl2(过量) |
| B.稀HNO3+Fe(少量) |
| C.FeCl2(过量)+Cl2 |
| D.Fe+浓盐酸(过量) |
若NA表示阿伏伽德罗常数的值,下列说法正确的是
| A.0.1mol/L的 CaCl2溶液中所含Cl﹣数为0.2NA |
| B.7.8g Na2O2与足量水反应,转移电子数为0.2NA |
| C.常温常压下,8g CH4含有的分子数为0.5NA |
| D.常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA |