有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A的原子核无中子,能与B、C分别形成10电子的化合物;B、C 的质子数之和与E的质子数相等,B、C的族序数为奇数;D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数.试回答下列问题:
的质子数之和与E的质子数相等,B、C的族序数为奇数;D、E位于同一周期,D的阳离子所带的正电荷数等于该阳离子的电子层数.试回答下列问题:
(1)C与D形成的化合物的电子式 .
(2)写出D的单质与CO2反应的化学方程式 .
(3)“嫦娥 一号”发射所用的液体燃料是上述 (填元素名称)元素的单质.
一号”发射所用的液体燃料是上述 (填元素名称)元素的单质.
(4)工业上,使元素E的低价氧化物转化为其最高价氧化物的设备名称为 .
(5)在一定的条件下,A2、B2混合物经过一段时间的反应后,B2的浓度减小了0. 3 mol/L.[此时间内A2表示的化学反应速率为0. 45 mol/(L·s).则此段反应时间为 s
对于反应2SO2(g)+O2(g)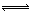 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
降低温度 |
|
| ② |
加入氮气 |
|
| ③ |
用催化剂 |
|
| ④ |
压缩体积 |
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物。
试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______。
(2)D元素位于周期表中周期族。
(3)写出AB2与C2B2反应的化学方程式。
(4)画出B的原子结构简图 ___________________。
(5)用电子式表示化合物 C2D 的形成过程:。
(12分)化学式为C11H12O4的芳香族化合物A、B互为同分异构体,A和D都能发生银镜反应,E的一溴取代物同分异构体有两种,A经①②两步反应得C、D和E。B经①②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。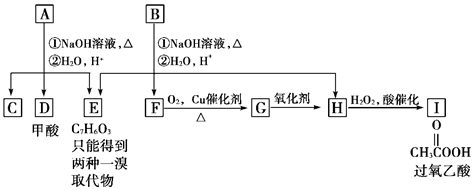
(1)A有2种可能结构,写出其结构简式:____________________________________。
(2)在B、C、D、F、G、I化合物中,互为同系物的是__________________________。
(3)写出D与F在加热和浓H2SO4催化作用下发生反应的化学方程式:
_________________________________。反应类型:__________________。
(4)除银镜反应和点燃外至少选用其他两种实验方法证明D具有还原性,请按要求填写下表:
| 所选试剂的化学式 |
观察到的实验现象 |
|
| 方法1 |
||
| 方法2 |
工业上用甲苯生产对羟基苯甲酸乙酯 ,其生产过程如下图,根据下图回答:
,其生产过程如下图,根据下图回答: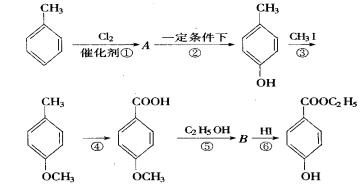
(1)有机物A的结构简式为。
(2)反应⑤的条件是
(3)反应②的反应类型是(填编号,下同),反应④的反应类型属。
| A.取代反应 | B.加成反应 | C.氧化反应 | D.酯化反应 |
(4)反应③的化学方程式(不用写反应条件,但要配平):
。
(5)在合成线路中,设计第③和⑥这两步反应的目的是:
。
(6分)由以下五种基团一CH3、 、一CHO、一COOH、一OH,
、一CHO、一COOH、一OH,
其中两两结合而形成的化合物,写出所有能与NaOH溶液反应的有机物结构简式。