 某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。 (1)A的分子式为
(1)A的分子式为  ,A分子中最多在同一平面的原子数为 ;
,A分子中最多在同一平面的原子数为 ; (2)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%
(2)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7% ,写出此化合物的结构简式 ;
,写出此化合物的结构简式 ; (3)已知:
(3)已知: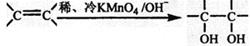 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式 ;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式 ; (4)根据马氏规则:不对称加成时,通常“氢加到含氢多的不饱和碳原子一侧”,写出A与HBr反应主要产物B的结构简式 ;化合物B有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: 。
(4)根据马氏规则:不对称加成时,通常“氢加到含氢多的不饱和碳原子一侧”,写出A与HBr反应主要产物B的结构简式 ;化合物B有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: 。
①含苯环 ②苯环上只有两种不同化学环境的氢原子。
下列有关使用托盘天平的叙述,不正确的是(填写标号)
| A.称量前先调节托盘天平的零点; |
| B.称量时左盘放被称量物,右盘放砝码; |
| C.潮湿的或具有腐蚀性的药品,必须放在玻璃皿里称量,其它固体药品可直接放在天平托盘上称量; |
| D.用托盘在平可准确称量至0.01g; |
E.称量完毕,应把砝砝放回砝码盒中.
A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D,D和A形成简单离子后,它们的电子层相差两层,已知A处于第n族,D处于第m族,且A单质中含有共价键,B的气态氢化物的分子式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等,C和A形成CA3型化合物,C与A、B在同一周期,B与A左右相邻,试回答:
(1)C离子的结构示意图为[
(2)向B的氢化物的水溶液中滴入A单质的水溶液,发生反应的化学方程式为.
(3)向A、C形成的化合物的水溶液中滴入氨水,其反应的离子方程式为___________________
有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛 的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→C,G→麻黄碱的部分反应物和条件):
的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→C,G→麻黄碱的部分反应物和条件):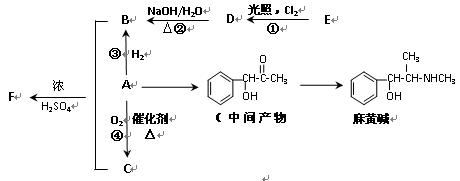
请回答下列问题:
(1)下列关于麻黄碱的说法正确的是(填字母)。
a.麻黄碱的分子式为C10H15NO b.麻黄碱能与NaOH溶液反应
c.麻黄碱能发生加成和取代反应 d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量分数之比为42∶3∶8,
则A的含氧官能团名称是;检验该官能团的常用试剂是。
(3)反应①~⑤中属于取代反应的是(填序号)。
(4)写出D→B的化学方程式。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式。
(6)写出符合下列条件的同分异构体的结构简式。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
| 溶解性 |
沸点 |
|
| A |
微溶于水 |
179.0℃ |
| E |
不溶于水 |
110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是。
氢化阿托醛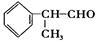 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下: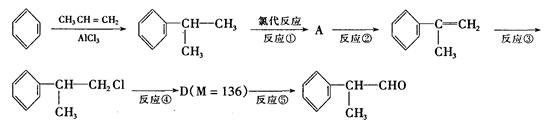
(1)在合成路线上②③的反应类型分别为②③ 。
(2)由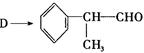 反应的化学方程式为。
反应的化学方程式为。
(3)1mol氢化阿托醛发生银镜反应最多可生成molAg。
(4)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有种。
有机物F、G是常见的塑料,可通过下图所示路线合成: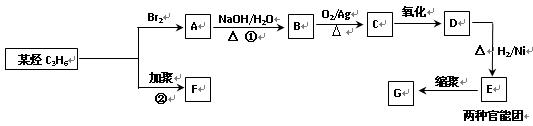
(1)高分子化合物G的结构简式是 。
(2)反应②的化学方程式是 。
(3)PBT(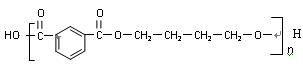 )是一种重要的工程塑料。
)是一种重要的工程塑料。
结合所学知识,请设计方案以CH2=CHCH=CH2 、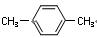 为原料合成PBT(请用反应流程图表示,并注明反应条件)。
为原料合成PBT(请用反应流程图表示,并注明反应条件)。
示例:由乙醇合成聚乙烯的反应流程图可表示为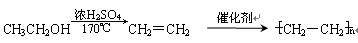
合成PBT的反应流程图为:
___________________________________________________________________________