(15分,每空3分)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
 实验步骤 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为: 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为: 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团: 。 |
(4)A的核磁共振氢谱如下图: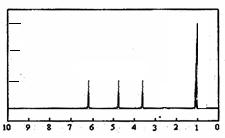 |
(4)A中含有 种氢原子。 |
| (5)综上所述,A的结构简式 。 |
过氧化钠与铝粉混合物18.3g,加入100mL水,充分反应后混合物完全溶解,并收集到5.6L气体(标准状况)。
(1)写出铝粉参加反应的离子方程式_______________。
(2)收集到的气体成分是________________,体积比是_______________。反应后溶液中NaAlO2的物质的量浓度是(设溶液体积不变)_________________________。
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知未知X。
(1)已知KBrO3在反应中得到电子,该反应的还原剂是__________。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______。
(3)根据上述反应可推知_______。
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4> KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方向和数目:
现有4.6gNa、2.4gMg、2.7gAl和6.4gCu,分别将其投入盛有100mL1.5mol/L盐酸的4个烧杯。
(1)各烧杯中可能发生反应的化学方程式为:___________、_____________、__________、______________。
(2)反应结束后,没有剩余的金属是:__________(填元素符号);
(3)反应结束后,产生气体的物质的量分别为:
①投入Na的烧杯,生成气体____mol;
②投入Mg的烧杯,生成气体____mol;
③投入Al的烧杯,生成气体____mol;
④投入Cu的烧杯,生成气体____mol;
物质A~E均含同种元素,都是中学化学中常见的物质,它们可发生如图所表示的反应。已知A是一种淡黄色的固体,B是银白色金属单质。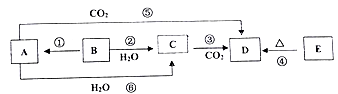
(1)反应⑤可用于潜水艇中制取氧气,相关的化学方程式为:__________________,氧化剂是______,还原剂是______;
(2)根据反应②相关的现象,从表格下方找出相应性质序号填在表格中,并在对应的位置写上该反应的化学方程式。
| 现象 |
单质B的相关性质(填序号) |
相关的化学方程式 |
|
| I |
单质B浮在水面上 |
||
| II |
熔成一个小球 |
||
| III |
四处游动,发出嘶嘶的声音 |
||
| IV |
滴入酚酞试剂,溶液变红 |
与反应现象相应的性质:①反应后生成了酸性物质;②反应后生成了碱性物质;③单质B的熔点低;④单质B的密度比水的小;⑤生成了气体;⑥单质B的密度比水的密度大;
(3)D和E分别与等浓度的盐酸反应,相同条件下生成等体积的气体,则以下说法正确的是:
________(填序号)
①消耗D的质量较多;②消耗E的质量较多;③D消耗盐酸的体积更大 ④E消耗盐酸的体积更大
实验室常用NaOH溶液和氨水(NH3·H2O)两种碱溶液来制取不同的金属氢氧化物,请选择合适的试剂来制取以下的金属氢氧化物:
(1)要制取Fe(OH)3时,可用NaOH溶液与______(写化学式)反应,所得到的沉淀为____色,离子方程式为:____________。
(2)要制取Fe(OH)2时,可用NaOH溶液与______(写化学式)反应,所得到的沉淀为____色,离子方程式为:____________。
(3)要制取Cu(OH)2时,可用NaOH溶液与______(写化学式)反应,所得到的沉淀为____色,离子方程式为:____________。
(4)要制取Al(OH)3时,可用氨水与______(写化学式)反应,所得到的沉淀为____色,离子方程式为:____________。