氧化还原反应实际上包含氧化和还原两个过程:①向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2 + 2H2O – 2e-→ SO42-+ 4H+;②向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-,在①和②反应中均会生成产物X,则X的化学式为 ( )
| A.NaClO | B.HClO | C.ClO2 | D.NaClO4 |
下列各组离子在指定的条件下一定能大量共存的是
| A.pH=1的溶液中:Na+、Fe2+、NO3-、Cl- |
| B.pH=7的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| C.使酚酞变红的溶液中:Ba2+、Cl-、Na+、NO3- |
| D.加入铝粉产生氢气的溶液:Na+、Cu2+、Cl-、NO3- |
造纸工业中常用Cl2漂白纸浆,漂白后的纸浆用NaHSO3除去残留的Cl2,其反应为:Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl,在这个反应中,氧化产物与还原产物的物质的量之比为
| A.2︰3 | B.3︰1 | C.2︰1 | D.1︰2 |
如下图所示,向A中充入1 mol X和1 mol Y,向B中充入2 mol X和2 mol Y,起始时V(A)="V(B)=a" L。在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g) 2Z(g)+W(g);△H>0,达到平衡时,V(A)="1.1a" L。下列说法不正确的是
2Z(g)+W(g);△H>0,达到平衡时,V(A)="1.1a" L。下列说法不正确的是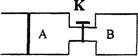
A.反应开始时,B容器中化学反应速率比A容器中快
B.A容器中X的转化率为20%,且比B容器中X的转化率小
C.打开K一段时间,达新平衡时,A的体积为2.3a L(连通管中气体体积不计)
D.打开K达新平衡时,升高B容器的温度,A容器的体积会增大
已知4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H=﹣xkJ/mol。蒸发1mol H2O(l)需要吸收的能量为44kJ,其它相关数据如下表:
| NH3(g) |
O2(g) |
NO(g) |
H2O(g) |
|
| 1mol分子中的化学键断裂时需要吸收的能量/kJ |
a |
b |
z |
d |
则表中z(用x、a、b、d表示)的大小为
A.(x+4a+5b﹣44)/4B.(x+12a+5b﹣12d﹣264)/4
C.(x+4a+5b﹣6d﹣264)/4 D.(x+12a+5b﹣12d﹣44)/4
E和F加入密闭容器中,在一定条件下发生反应: E(s)+4F(g) G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
| 温度℃ |
25 |
80 |
230 |
| 平衡常数值 |
5×104 |
2 |
1.9× 10﹣5 |
A.上述反应是熵增反应
B.25℃时,反应G(g) E(s)+4F(g)的平衡常数值是0.5
E(s)+4F(g)的平衡常数值是0.5
C.在80℃时,测得某时刻,F、G浓度均为0.5 mol·L﹣1,则此时v(正) >v(逆)
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大