下列反应的离子方程式正确的是
| A.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-= NH3↑+H2O |
| B.足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2=2Fe3++2Cl- |
| C.硫酸铜溶液中加过量的氨水:Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+ |
| D.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32- |
已知:t℃下的某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: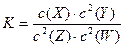 ,有关该平衡的说法中正确的是
,有关该平衡的说法中正确的是
| A.升高温度,平衡常数K变大 |
| B.增大压强,W(g)的物质的量分数变大 |
| C.增大Z的浓度,平均向正反应方向移动 |
| D.升温,若混合气体的相对分子质量变小,则逆反应放热 |
乙酸分子的结构式为,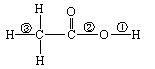
下列反应及断键部位正确的是
(1)乙酸的电离及与酸的通性有关的反应是①键断裂
(2)乙酸与乙醇的酯化反应是②键断裂
(3)在红磷存在时,Br2与CH3COOH的反应为: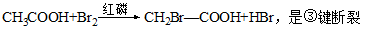
(4)乙酸变成乙酸酐的反应为: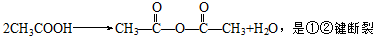
| A.(1)(2)(3) | B.(1)(2)(3)(4) | C.(2)(3)(4) | D.(1)(3)(4) |
一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
A.由上图反应情况可知,该反应的化学方程式应为3B+4C=6A+2D
B.反应进行到1 s 时,υ(A)=υ(D)
C.反应进行到6 s时,各物质的反应速率相等
D.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
下列离子方程式的书写错误的是
| A.0.01mol·L-1Na2S2O3溶液与0.01mol·L-1 H2SO4溶液等体积混合: S2O32-+2H+=S↓+SO2+H2O |
| B.0.01mol·L-1 KMnO4酸性溶液与0.2mol·L-1 H2C2O4溶液等体积混合: 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
| C.0.005mol·L-1FeCl3溶液与0.01mol·L-1KSCN溶液等体积混合: Fe3++3SCN-=Fe(SCN)3 |
| D.0.1mol·L-1KI溶液与0.01mol·L-1H2SO4溶液等体积混合: |
2I-+2H++SO42-=I2+SO2↑+H2O
断裂下列气态物质的化学键需要吸收的能量分别为:H-H为436 kJ·mol-1;F-F为153 kJ·mol-1;H-F为565 kJ·mol-1。下列说法正确的是
| A.H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g) ΔH=-541 kJ |
| B.44.8 L HF气体分解成22.4 L H2和22.4 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |