1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知每摩单质碳完全燃烧生成CO2放出热量为Y kJ,则1mol C与O2反应生成CO的反应热△H为
| A.-Y kJ/mol | B.-(10X-Y) kJ/mol |
| C.-(5X-0.5Y) kJ/mol | D.+(10X-Y) kJ/mol |
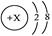 表示某带电微粒的结构示意图,则可用它表示的阳离子共有( )。
表示某带电微粒的结构示意图,则可用它表示的阳离子共有( )。
| A.1种 | B.3种 | C.4种 | D.5种 |
已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D、T,从水分子的原子组成看,自然界的水一共有()
A.3种 B.6种 C.9种 D.18种
同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4下列推断正确的是()
| A.原子序数:X<Y<Z | B.气态氢化物稳定性:XH3<YH3<ZH3 |
| C.元素的非金属性强弱:X>Y>Z | D.电子层数:X<Y<Z |
CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过如图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是( )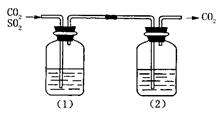
| A.(1)NaOH (2)浓H2SO4 | B.(1)浓H2SO4 (2)NaOH |
| C.(1)饱和NaHCO3 (2)浓H2SO4 | D.(1)浓H2SO4 (2)Na2CO3 |
相同条件下,在容积相同的三个烧瓶内分别充满干燥的NH3、HCl、NO2气体,做喷泉实验,所得三种溶液的物质的量浓度比为
| A.3:3: 2 | B.2:2:3 | C.1:1:1 | D.无法比较 |