对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有SO、Na+、CO、H+ 、NO、HCO、Cl-等离子中的若干种。然后又作了如下分析,以确定这些离子是否大量存在。
、NO、HCO、Cl-等离子中的若干种。然后又作了如下分析,以确定这些离子是否大量存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是__________,一定不存在的离子是____________。
(2)在上述实验操作中,有错误的步骤是(填代号)______。对该错误改正的方法是(要作较详细的说明)_______________________________________________ ___。
___。
(3)到目前为止,不能肯定在原溶液中是否存在的离子是______ ______。
【化学——选修3:物质结构与性质】已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素。其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态。请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)元素B、C的第一电离能的大小关系是(用元素符号填写),其原因为。
(2)A的的某种氢化物A2H2分子的空间构型是,其中心A原子采取的杂化形式为,分子中含有个 键,个
键,个 键。
键。
(3)写出E原子的核外电子排布式是,用电子式表示化合物DC的形成过程。
(4)由E元素形成的金属的晶胞结构如图,已知该晶胞边长为a厘米,该晶体的密度为。(用NA表示阿伏伽德罗常数的值)
(5)配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于(填晶体类型)。
【化学——选修2:化学与技术】由Ca3(PO4)2、SiO2、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。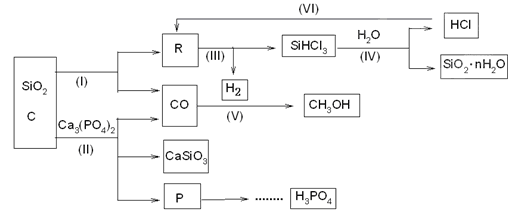
(1)上述反应中,属于置换反应的是[选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]
(2)高温下进行的反应Ⅱ的化学方程式为: ;
固体废弃物CaSiO3可用于 。
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是。
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为____________________。
(5)指出(VI)这一环节在工业生产上的意义
(6)写出由P→H3PO4有关反应式
① ② ____________________________
将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2。完成下列化学方程式:
(1)_____KMnO4+______K2S+______KOH ===______K2MnO4+______K2SO4+______S↓+_____
(2)若生成5.44 g单质硫,反应过程中转移电子的物质的量为________;若反应中有22 mol电子转移,则生成K2SO4和S的物质的量之比为__________。
(4分)在50 mL 9 mol/L的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol/L。
(1)则生成的气体中NO2的物质的量为_______ mol。
(2)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O;2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol/L的NaOH恰好被吸收,NaOH溶液的体积为_______ mL
W、X、Y、Z为短周期内(除稀有气体元素外)的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,X与Z属于同一主族的元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素的质子数之和的3倍。
(1)由此可知元素W为_______; Y 为_______;(都填元素名称)
(2)Z位于元素周期表中第______周期,第____族
(3)W分别与X、Z能形成相应的氢化物,这两种化合物的沸点由高到低的顺序为______________(用分子式表示)
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________>________>________>________。
(5)由上述四种元素组成盐反应的离子方程式____________________________
(6) Z的低价氧化物通入Cl2单质的水溶液中,发生反应的化学方程式为____________。