某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象:( )
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子组是
A.Al3+、Mg2+、I-、SO32- |
B.Mg2+、Na+、CO32-、I- |
| C.Al3+、Na+、SO32-、I- | D.Al3+、CO32-、Br-、SO32- |
下列物质不属于醇类的是()
A. |
B.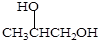 |
C.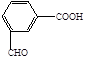 |
D. |
甲型H1N1流感对人们生活产生了很大影响,一旦发现流感病人,隔离、消毒极为重要,常用消毒剂有过氧乙酸、漂白粉、甲醛等。关于甲醛,下列说法错误的是()
| A.常温下甲醛为气体,故可作为熏蒸消毒剂 |
| B.甲醛可使蛋白质变性,故可杀灭病毒 |
| C.甲醛与漂白粉混用,效果更好 |
| D.甲醛氧化可得甲酸,甲酸氧化的产物为CO2和H2O |
在淀粉溶液中加入淀粉酶,一段时间后取出部分水溶液滴加碘水,不变蓝色,则证明水溶液中不含有()
| A.淀粉 | B.葡萄糖 | C.高分子 | D.蛋白质 |
下列实验操作不正确的是()
| A.实验室制乙烯时,为防止暴沸,应加入沸石 |
| B.不慎将苯酚溶液沾到皮肤上,应立即用稀NaOH溶液清洗 |
| C.饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 |
| D.向AgNO3溶液中逐滴加入稀氨水,至沉淀恰好溶解,制得银氨溶液 |
下列物质①乙烷 ②丙烷 ③乙醇,沸点由高到低的顺序正确的是()
| A.①>②>③ | B.②>①>③ | C.③>②>① | D.③>①>② |