将1 mol A(g)和2 mol B(g)置于2L某密闭容器中,在一定温度下发生反应: A(g)+B(g)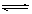 C(g)+D(g),并达到平衡。C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图II所示,下列说法不正确的是
C(g)+D(g),并达到平衡。C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图II所示,下列说法不正确的是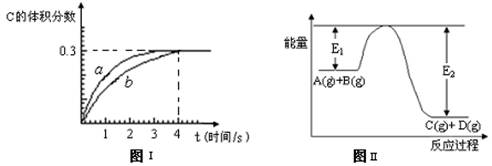
A.反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是0.225mol·L-1·s-1
B.该温度下,反应的平衡常数数值约为7.36
某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数,下列说法中正确的是
A.氧元素的相对原子质量为 |
| B.1mol该原子质量为aNAg |
C.xg该氧原子所含的电子的个数为 |
D.yg该氧原子的中子数一定为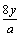 |
下列有关性质的比较,不能用元素周期律解释的是
| A.酸性:H2SO4>H3PO4 | B.非金属性:Cl>Br |
| C.碱性:NaOH>Mg(OH)2 | D.热稳定性:Na2CO3>NaHCO3 |
下列方法中,不能用于实验室制取氨的是
| A.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热 |
| B.加热试管中的氯化铵固体 |
| C.将烧瓶中的浓氨水加热 |
| D.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中 |
下列说法正确的是
| A.同一主族相邻两个周期的元素的原子序数差一定等于上一周期所含元素种类 |
| B.114号元素可能为非金属元素 |
| C.L层上的电子数为奇数的元素一定是主族元素 |
| D.目前使用的长式元素周期表中,最长的周期含36种元素 |
下列有关实验的现象描述正确的是
| A.氢气在氯气中燃烧,火焰呈苍白色,瓶口出现大量白雾 |
| B.磷在氯气中燃烧,发出明亮的蓝紫色火焰,产生大量白色烟雾 |
| C.铜在氯气中燃烧,产生白烟,加水溶解后可得蓝绿色溶液 |
| D.用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 |