某学生设计氨催化氧化实验(在催化剂存在时氨被氧气氧化生成NO和H2O),并将制得的NO进一步氧化为NO2,再用水吸收NO2并检验HNO3的生成。
可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:如图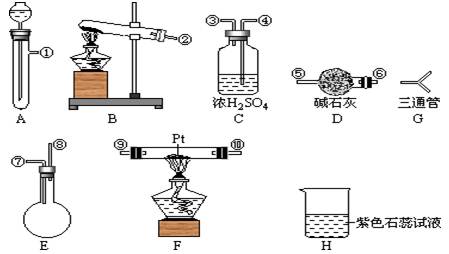
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。设计实验时,A和B两个制气装置允许使用两次,其余装置只能使用一次。
(1)氨氧化制NO的化学反应为_______________,该反应应在装置____中进行。
(2)为快速制NH3和O2,制取NH3的装置最好选择_______,其化学反应方程式为______________;制取O2的装置最好选择_______,其化学反应方程式为_____________________。
(3)各仪器按气流方向连接的正确顺序为A、B→G→ → →C → E→ [按装置先后顺序排列]
(4)如果实验前需收集一试管的氨气,如何采用一种简易方法检验试管中氨气是否集满(简述操作、现象和结论)
(5)装置C的作用是___________________。
(6)若经充分反应,从H中排出的气体对大气不会造成污染。装置E的使用方法是将E倒置,⑦为进气口,⑧为出气口,⑧插入H装置中.H中溶液变红,其原因是(用化学方程式表示)______________________。
乙二酸(H2C2O4)俗名草酸,草酸易溶于水,市售消字灵一般为高锰酸钾和草酸的混合溶液。
(1) 在KMnO4与H2C2O4反应中,可通过测定____________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:____________________________;
(2) 某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,H2C2O4水溶液可以用酸性KMnO4溶液进行滴定
该组同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③已知用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,逐滴加入到装有草酸溶液的锥形瓶中,到滴定终点时,停止滴定。开始时读数及恰好反应时KMnO4溶液的读数见下表。
| 实验编号 |
待测草酸溶液体积(mL) |
滴定开始读数(mL) |
滴定结束读数(mL) |
| ① |
25.00 |
0.00 |
10.00 m |
| ② |
25.00 |
1.00 |
11.02 |
| ③ |
25.00 |
0.22 |
12.00 |
请回答:滴定时,将KMnO4标准液装在(填“酸式滴定管”或“碱式滴定管”)中。
请在下面空白处通过上述数据,计算出待测的草酸的物质的量浓度mol/L。计算出x=。若滴定终点时俯视滴定管刻度,则由此测得的x值会;若滴定后,滴定关尖嘴处有气泡,则由此测得的x值会。填“偏大”、“偏小”或“不变”)。
(16分)铁是人类较早使用的金属之一。运用铁的有关知识,回答下列问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的 微粒大小范围是nm
微粒大小范围是nm
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3 溶液与铜反应的离子方程式
溶液与铜反应的离子方程式 。
。
检验反应后的溶液中还存在Fe3+的试剂是
(3)欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①蒸馏水
②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水⑦氯气,需要用到的试剂是(填序号)
整个实验过程中涉及到的离子方程式
、
、、
、
某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____ (填写装置的序号)。
(3)装置B中发生反应的离子方程式为________________________________________。
(4)装置C中的现象为___________________________________________________,
试结合反应方程式解释其原因 ___________________________________
_________________________________。
(5)装置E中的试剂是______________(任填一种合适试剂的名称),其作用是________
_______________________________ ______。
(6)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验 步骤)
步骤)
_________________________________________________________________________
_________________________ __________________________ ______________
__________________________ ______________
(1)标准状况下,44.8L的NH3气体质量为g,其中含 个氮原子,其中含 mol 氢原子。
(2)标准状况下,11.2L的H2R气体质 量为17g,则H2R的摩尔质量是,等质量的NH3与H2R的物质的量比为,1.7g氨气与mol H2O含有的电子数相等。
量为17g,则H2R的摩尔质量是,等质量的NH3与H2R的物质的量比为,1.7g氨气与mol H2O含有的电子数相等。
(3)过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:
2Na2O2 + 2CO2 = 2Na2CO3 + O2; Na2O2 + CO = Na2CO3
试分别写出Na2O2与SO2、SO3反应的化学方程式:
(4)取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并写出相关的化学方程式:
①实验现象 

②有关的化学方程式是。
。
某化学实验小组,通过Li3N固体水解生成氢氧化锂和氨气的反应制氨气,并进行氨气还原氧化铜的实验探究。如下图所示,给出了本实验可供选择的装置: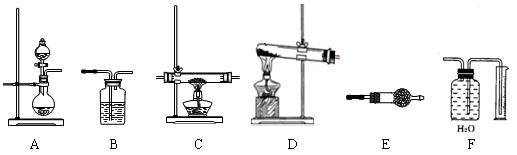
请回答下列问题:
(1)按该方法制氨气时,应选用上述装置中的(填装置代码,下同)做氨气发生装置。
(2)为检验氨气还原氧化铜反应后生成Cu、H2O、N2,氨气发生装置后应依次连接→ C →→→
(3)在C装置前后连接的装置中,填充的药品按前后顺序分别为、。
(4)有资料提出:CuO被还原时,当黑色固体完全变为红时,不一定完全转化为Cu,可能还含有Cu2O。已知查阅到一离子反应方程式:Cu2O+2H+=Cu2++Cu+H2O。依据该信息,若证明C处的红色固体中是否含有Cu2O ,请设计实验:。
(5)实验时充分加热,至C装置质量不再减轻为止。实验完毕后,若实验测得收集的N2体积为aL(已折算为标准状况)。则若用CH4还原同样多CuO,理论上最少需要CH4的体积为(标准状况,用含字母a的代数式表示)L。