在恒温恒容条件下将一定量NO2和N2O4的混合气体通入密闭容器中,发生反应。反应中各组分浓度随时间变化关系如图。下列说法中,正确的是
| A.a、b、c、d四个点中,只有b点的化学反应处于平衡状态 |
| B.前10 min内用υ(NO2)表示的化学反应速率为0.04 mol/(L·min) |
| C.25 min时,导致平衡移动的原因是升高温度 |
| D.a点,用υ(NO2)表示的化学反应速率等于用υ(N2O4)表示的化学反应速率 |
下列叙述正确的是
| A.等质量的铝分别与足量氢氧化钠溶液和稀硝酸反应,放出的氢气一样多 |
B.将SO2通入过量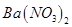 溶液可生成 溶液可生成 沉淀 沉淀 |
| C.自来水厂常用明矾对水进行杀菌、消毒 |
| D.将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 |
设NA为阿伏加德罗常数的数值,下列叙述正确的是
A.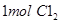 与足量Fe反应转移电子数一定为3NA 与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,22.4L NH3中含有共价键的数目为NA |
C.1.0L 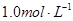 的 的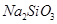 水溶液中含有的氧原子数为3NA 水溶液中含有的氧原子数为3NA |
D.4.6g Na完全转化成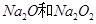 的混合物,混合物中阴离子总数为0.1NA 的混合物,混合物中阴离子总数为0.1NA |
C、N、S都是重要的非金属元素,下列说法正确的是
A.三者对应的氧化物均为酸性氧化物
B.实验室可用NaOH溶液处理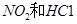 废气
废气
C.三者的单质直接与氧气反应都能生成两种氧化物
D.CO2、NO2、SO2都能与H2O反应,其反应原理相同
下列反应的离子方程式正确的是
A.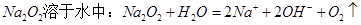 |
B.用FeC13溶液腐蚀电路板: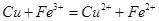 |
C.向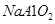 溶液中通入过量 溶液中通入过量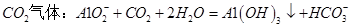 |
D.用食醋除去水瓶中的水垢: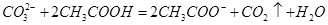 |
关于元素及其化合物,下列说法正确的是
| A.C12具有氧化性,故可以做漂白剂 |
| B.Na、A1、Fe三种单质在一定条件下与水反应都生成H2和对应的碱 |
| C.将浓硝酸、浓硫酸露置在空气中,两溶液的质量均增大、浓度均减小 |
D.将表面有铜绿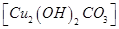 的铜器放入盐酸中浸泡,可除去铜绿 的铜器放入盐酸中浸泡,可除去铜绿 |