氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: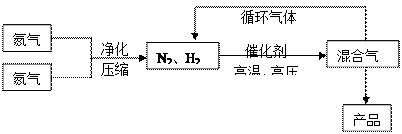
| 气体 |
氮气 |
氢气 |
氨 |
| 熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
| 沸点(℃) |
-1 95.79 95.79 |
-259.23 |
-33.42 |
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 ℃使混合气体分离出来产品;继续循环的气体是 。
(2)工业上采取用上述 (1)操作的目的:
(1)操作的目的:
。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ 。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大
氢气是一种理想的“绿色能源”,下图为氢能产生与利用的途径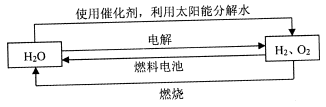
(1)上图中4个过程中能量转化形式有_____________。
| A.2种 | B.3种 | C.4种 | D.4种以上 |
(2)电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解
以上反应的△H1_____________△H2 (选填“>"、“<”或“=”)。
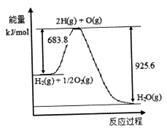
(3)已知H2 O(1)→H2 O(g)△H=" +44" mol·L-1,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式________________________________。
(4)氢能利用需要选择合适的储氢材料
①镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) LaNi5H6(s) △H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是___________。
LaNi5H6(s) △H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是___________。
②一定条件下,如图所示装置可实现有机物的电化学储氢,总反应:2C7 H8+6 H2O(1) 2C7 H14+3O2 (g) 电解过程中产生的气体X为_________,电极A发生的电极反应式为____________。
2C7 H14+3O2 (g) 电解过程中产生的气体X为_________,电极A发生的电极反应式为____________。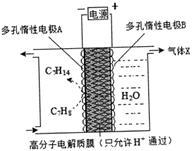
(1) 一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。
①如果溶液pH=7,此时V的取值__ ___20.00(填“>”、“<”或“=”),而溶液中 c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= _________mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:
①若将Na2CO3和NaHCO3混合物配成溶液,
则此溶液的pH的取值范围是 ;
②为测定Na2CO3和NaHCO3混合物中的质量分数,下列方案可行的是 。
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式 。
(2)已知:乙烯气相直接水合反应如下:
C2H4(g)+H2O(g)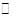 C2H5OH(g) H=-45.5KJ/mol
C2H5OH(g) H=-45.5KJ/mol
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)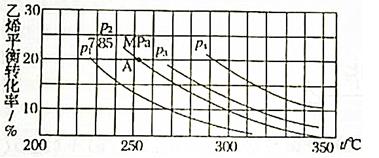
①计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= (Kp表示用平衡分压代替平衡浓度计算出的平衡常数的值,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是 。
(3)若某温度下,反应C2H4(g)+H2O(g)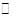 C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示。
C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示。
| 物质 |
C2H4(g) |
H2O(g) |
C2H5OH(g) |
| 物质的量分数 |
0.25 |
0.25 |
0.5 |
则v(正) v(逆)(填“>”“<”“=”)。
活性ZnO俗称锌白,能改进玻璃的化学稳定性,可用于生产特种玻璃。工业上由粗锌ZnO(含FeO、CuO等)制备ZnO,采取酸浸入、净化除杂、中和沉淀、干燥等步骤,工艺如下:
(1)该流程中物质X可以是下列中的()
| A.ZnO | B.NaOH | C.Zn(OH)2 | D.Na2CO3 |
(2)已知ZnO为两性氧化物,与氢氧化钠溶液反应可生成可溶性的锌酸盐(ZnO22-),写出反应的离子方程式 ;
(3)写出加入H2O2时发生反应的离子方程式 ;
(4)加入Zn后,过滤所得的滤渣有 ;
(5)上述流程中多次用到了过滤操作,请写出过滤时用到的玻璃仪器: ;
(6)检验滤液A中溶质的阴离子的方法是 。
(7)取碱式碳酸锌水合物6.82g,溶于盐酸中生成二氧化碳448mL(标况下),溶解过程消耗氯化氢0.12摩尔,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱是碳酸锌水合物的化学式是 。
根据题意完成下列方程式
(1)写出实验室制备氨气的化学方程式 ;
(2)写出实验室制备Cl2的离子方程式 ;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;K2FeO4-Zn可组成碱电池,电池总反应式为:2Fe O42-+8H2O+3Zn=2Fe(OH)3+3Zn(OH)2+4OH-。写出该电池的正极反应式 ;