
 某同学用沉淀法测定碳酸钠和氢氧化钠混合物中氢氧化钠的质量分数,有关叙述如下:
某同学用沉淀法测定碳酸钠和氢氧化钠混合物中氢氧化钠的质量分数,有关叙述如下:
①检验 是否完全沉淀的操作方法是,取上层清液装于试管,向试管滴加沉淀剂溶液
是否完全沉淀的操作方法是,取上层清液装于试管,向试管滴加沉淀剂溶液
②检验 是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
③用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是实验结果准确度较高
④用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是碳酸钡能完全沉淀
其中正确的是( )
| A.①③ | B.②③ | C.②④ | D.①④ |
下列几种情况,对中和滴定结果无影响的是()
| A.滴定前标准液在零刻度以上 |
| B.盛未知浓度溶液的锥形瓶里有少量蒸馏水 |
| C.滴定管用蒸馏水冲洗后即注入标准液 |
| D.滴定终点读数时,俯视滴定管的刻度(其他操作均正确) |
可逆反应aA(?)+2 B(g)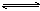 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是()
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是()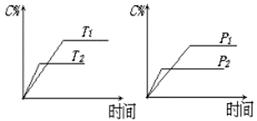
| A.达到平衡后,加入催化剂则C%增大 |
| B.达到平衡后,若升高温度,平衡向右移动 |
| C.a可以为任意的正整数 |
| D.达平衡后,增加A的量,有利于平衡向右移动 |
已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是()
①生成物的体积分数一定增加;②生成物的产量一定增加;③反应物的转化率一定增大;④反应物浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥使用了合适的催化剂。
| A.①② | B.②⑤ | C.③⑤ | D.④⑥ |
下面是合成氨的简要流程示意图:
沿x路线回去的物质是()
| A.N2和H2 | B.催化剂 | C.N2 | D.H2 |
把0.05molNaOH固体分别加入下列100mL液体中,溶液的导电性基本不变的是()
A 自来水B 0.5mol·L-1的盐酸 C 0.5mol·L-1的醋酸 D 0.5mol·L-1的氨水