下列反应的离子方程式书写正确的是( )
| A.氯化铝溶液中加入过量氨水: Al3++4NH3·H2O===AlO+4NH+2H2O |
B.澄清石灰水与少量 苏打溶液混合: Ca2++OH-+HCO===CaCO3↓+H2O 苏打溶液混合: Ca2++OH-+HCO===CaCO3↓+H2O |
C.碳酸钙溶于醋酸: CaCO3+2H+===C a2++CO2↑+H2O a2++CO2↑+H2O |
| D.氯化亚铁溶液中通入氯气: 2Fe2++Cl2===2Fe3++2Cl- |
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是 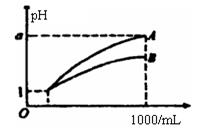
A. A、B两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液的酸性弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
放热反应CO(g)+H2O(g)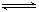 CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
| A.若增大CO的浓度,K2和K1都增大 | B.K2>K1 |
| C.c2(CO)=c2(H2O) | D.c1(CO)>c2(CO) |
用物质的量均是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),下列对该混合溶液的判断正确的是
| A.c(H+)>c(OH-) |
| B.c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 |
| C.c(CH3COOH)>c(CH3COO-) |
| D.c(CH3COO-)+c(OH-)=0.1mol·L-1 |
工业上制备纯硅时反应的热化学方程式为:SiCl4(g)+2H2(g)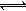 Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),在相同的温度、压强条件下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),在相同的温度、压强条件下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
| A.反应过程中,若减小压强会降低SiCl4的转化率 |
| B.若反应开始时SiCl4为1mol,则达到反应平衡时,吸收的热量为QkJ |
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L min) min) |
| D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好完全反应 |
下列关于小苏打水溶液的表述,正确的是
| A.c(Na+)=c(HCO3-)+ c (CO32-)+2c(H2CO3) |
| B.c(Na+) + c(H+)= c(HCO3-)+2c(CO32-) +c (OH-) |
| C.HCO3-的电离程度大于HCO3-的水解程度 |
D.存在的电离有:NaHCO3=Na++HCO3-,HCO3-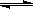 H++CO32- H++CO32- |