设阿伏加德罗常数的值为NA,则下列说法正确的是
| A.常温常压下,11.2L甲烷(CH4)中含有的氢原子数等于2NA |
| B.8g He所含的分子数为4 NA |
| C.1mol Fe与足量Cl2充分反应电子转移数为2 NA |
| D.18g的NH4+离子中含有的电子数为10NA |
常温时,一定能大量共存的离子组是
| A.能与Al反应生成H2的溶液中:Ca2+、NH4+、HCO3-、Cl- |
| B.能使甲基橙呈红色的溶液中:Na+、Mg2+、Br-、SO42- |
| C.pH=12的溶液中:Mg2+、K+、Cl-、NO3- |
| D.由水电离出的c(H+)=10-12mol/L的溶液中:K+、Ba2+、ClO-、CO32- |
将0.10mol/L的AlCl3溶液10mL与0.10mol/L的KOH溶液40mL充分混和,所得溶液中各种微粒的物质的量浓度关系正确的是
A.c(K+)>c(Cl-)>c(A lO2-)>c(OH-)>c(H+) lO2-)>c(OH-)>c(H+) |
| B.c(K+)>c(Cl-)>c(AlO2-)>c(H+)>c(OH-) |
| C.c(Cl-)>c (K+)>c(OH-)>c(AlO2-)>c(H+) |
| D.c(Cl-)>c(K+)>c(AlO2-)>c(OH-)>c(H+) |
已知A、B、C、D、E分别为Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气 体;“—”表
体;“—”表 示无现象)
示无现象)
| A |
B |
C |
D |
E |
|
| C |
↓ |
↓ |
— |
↑ |
— |
| B |
↓ |
— |
— |
↓ |
— |
据此可判断C是
A.HClB.Ca(HCO3)2C.Na2CO3D.Ba(NO3)2
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。其中一种镁电池的反应原理为: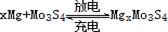 。下列说法不正确的是
。下列说法不正确的是
| A.放电时,Mo3S4发生氧化反应 |
| B.放电时,正极反应式:Mo3S4+2xe-→Mo3S42x- |
| C.充电时,Mg2+向阴极迁移 |
| D.充电时,阴极反应式:xMg2++2xe-→xMg |
设NA为阿伏加德罗常数。下列说法中正确的是
| A.1molNH4+中含有10NA个质子 |
| B.t℃时,1LpH=6的纯水中,含1×10-6 NA个OH- |
| C.78gNa2O2中含阴离子的数目为2 NA |
| D.向FeI2溶液中通入适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为1 NA |