在0.4 L由NaCl 、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。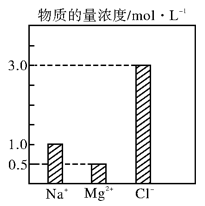
(1)该混合液中,NaCl的物质的量为____________mol,含溶质MgCl2的质量为______________g。
(2)该混合液中CaCl2的物质的量为____________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为______________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀____________mol。
(1)18.4 g氮的氧化物N2Ox中含氮原子0.4 mol,则N2Ox的摩尔质量为 ;x= ;
(2)设一个12C原子的质量为a g,一个R原子的质量为b g,阿伏加德罗常数的值为NA,则R的相对原子质量可以表示为__________________
(3)标准状况下,224L的NH3溶于680 ml水中,所得溶液的溶质质量分数为 ,若该溶液的密度为 a g/cm3,则其物质的量浓度为 mol·L-1。将上述氨水全部转化为NH4Cl,所需2 mol/L的盐酸的体积为 L(已知:NH3+HCl=NH4Cl)
在①渗析 ②聚沉 ③溶胶 ④凝胶 ⑤布朗运动 ⑥电泳 ⑦丁达尔现象 ⑧中和 ⑨水解中选出适宜的词语填入下列每小题的空格中(填编号):
(1)肥皂水中透过强光,可以见到光带。这种现象称为_____________________。
(2)在氢氧化铁胶体中加入硫酸,先产生红褐色沉淀后沉淀溶解,这种现象叫做___________________。
(3)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做___________________。
在 1.0L恒容密闭容器中放入0.10 mol A (g),在一定温度进行如下反应。A(g) 2B(g)+ C(g)+ D(s)△H=" +" 85.1 kJ / mol
2B(g)+ C(g)+ D(s)△H=" +" 85.1 kJ / mol
容器内气体总压强(P)与起始压强P。的比值随反应时间(t)变化数据见下表(提示:密闭容器中的压强比等 于气体物质的量之比)。
| 时间t/min |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
| P/P0 |
1.00 |
1.50 |
1.80 |
2.20 |
2.30 |
2.38 |
2.40 |
2.40 |
回答下列问题:
(1)下列能提高 A 的转化率的是 。
A.升高温度 B.向体系中通人A气体
C.减少D的物质的量 D.向体系中通人稀有气体He
(2)反应进行1小时,容器中剩余A的物质的量为 mol。
(3)平衡时A的转化率为
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则 D 的取值范围n(D)mol。
(5)将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时B的浓度为 。
工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法能说明上述反应向正反应方向进行的是____________________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是____________________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2 h时放出的热量为_________________kJ。
②此温度下该反应的化学平衡常数K=_________________(保留两位小数)。
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________________方向移动(填“正反应”或“逆反应”或“不移动”)。
④有甲、乙两个完全相同的容器,向甲容器中加入1 mol N2(g)和6mol H2(g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2 mol NH3(g)和3mol H2(g),达到平衡时的热效应(放热或吸热)为4Q。则甲容器中H2的转化率为________________。