掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
(1)写出下列仪器的名称:
①_____________②______________③______________④______________
(2)仪器①~④中,使用时必须检查是否漏水的有________(填序号)具体检查方法是_________________________________________________________________________________ 。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有____________,将仪器补充完整后进行的实验操作的名称为:_______________;使用时进水口为______(填f或g)。现需配制800mL 0.2 mol/L NaOH溶液,某该同学用托盘天平称取6.4克NaOH固体,其中装置II是该同学转移溶液的示意图,该同学操作的错误是
_
25℃时,①氢氟酸、②醋酸、③次氯酸的电离常数分别是3.5×10-4、1.8×10-5、3.0×10-8。请推测:它们的酸性由强到弱的顺序为______________________(填序号,下同),相同浓度的溶液中,氢离子浓度最大的是__________,电离程度最小的是_______;相同浓度的④氟化钠溶液、⑤醋酸钠溶液、⑥次氯酸钠溶液pH的从大到小顺序:_____________________________。
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性。
(1)写出实验室制取W2反应的离子方程式
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”) ;若装置D中装的是铁粉,当通入W2时D中观察到的现象为 ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学反应方程式为
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量YX2完全反应后,转移了mol电子,则该反应的化学方程式为
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母),可以看到白色沉淀生成。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
I.有关中和滴定的操作有:①用标准溶液润洗滴定管②往滴定管内注入标准溶液③检查滴定管是否漏水④滴定⑤洗涤
正确的操作顺序是(填字母)
| A.⑤①②③④ | B.③⑤①②④ | C.⑤②③①④ | D.②①③⑤④ |
Ⅱ.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是:2MnO4-+5HSO3-+H+= 2Mn2++5SO42-+3H2O
填空回答下列问题:
(1)不用(填“酸式”或“碱式”)滴定管盛放高锰酸钾溶液。
(2)选何种指示剂。(填序号)
①甲基橙②酚酞③石蕊④不用指示剂
(3)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则
(b-a)mL比实际消耗KMnO4溶液体积(填“多”或“少”)。根据(b-a)mL计算得到的待测液浓度,比实际浓度(填“大”或“小”)。
(4)无论是KMnO4溶液往NaHSO3溶液中滴,还是NaHSO3溶液往KMnO4溶液中滴,在其他操作正确规范的前提下,下列操作一定会使测定结果偏高的是。(填序号)
①取用NaHSO3溶液的滴定管未用待测NaHSO3溶液润洗
②取用KMnO4酸性溶液的滴定管未用标准KMnO4酸性溶液润洗
③滴定过程中不慎有液体溅出
④滴定前仰视读数,滴定后平视读数
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是。
(2)方案二:按下图装置进行实验。并回答以下问题。
①实验前先_______________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是。
②实验中除称量样品质量外,还需称___________装置前后质量的变化。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯外还用到的玻璃仪器有_______________;
②实验中判断沉淀是否完全的方法是。
③如加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(计算结果保留两位有效数字)。
(8分)有一乡村中学由于条件有限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝或废牙膏皮,各自设计了一种装置,制取并收集一试管氢气。(如图)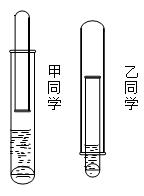
(1)哪个学生设计的装置比较合理?。另一个装置不合理的原因(至少说出一个原因)。
(2)用较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该采取的措施是。
(3)还可以用哪些物品代替牙膏皮和稀硫酸完成制取氢气的实验?
。