(15分)
(1)现有下列物质:维生素A、维生素C、碘元素、铁元素、淀粉、油脂。请选择正确答案填在相应的空格里。
①人体缺乏某种维生素会引起坏血病,这种维生素是__ __。
②人体缺乏某种微量元素会发生贫血,这种微量元素是____ __。
③既能为人体提供热量,又能提供必需脂肪酸的物质是____ _ ___。
___。
(2)了解一些用药常识,有利于自我保健。现有下列药物:碳酸镁、青霉素、阿司匹林、氢氧化铝。
①其中属于解热镇痛的药物是___ ___。
②青霉素的作用是__ _。
③碳酸镁可治疗胃酸过多的原理是 (用离子方程表示)。
④药片常用淀粉作为黏合剂,淀粉水解的最终产物是____ ____。
(3)生活中处处有化学,化学已渗透到我们的“衣、食、住、行”之中。
①衣:鉴别真假羊毛衫的方法是先取样,再_ _ __。
_ __。
②食:水是人类生存的必需物质。在净水过程中,明矾作为 剂;氯气或漂白粉作为 剂。
③住:玻璃和钢铁是常用的建筑材料。普通玻璃是由___ ____等物质组成的;钢铁制品不仅可发生化学腐蚀,在潮湿的空气中还能发生____ ____腐蚀。
④行:铝可用于制造交通工具,铝制品不易生锈的原因是____ ____;橡胶是制造轮胎的重要原料,天然橡胶通过____ _____措施可增大强度和弹性。
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)参照下图溶解度曲线,固体A是________(写化学式);固体B是________(写化学式);欲得到较纯的固体B需用少量的________(填“热水”或“冷水”)洗涤固体。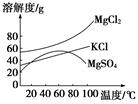
(2)操作⑤是实验室常用的过滤方法——减压过滤(俗称抽滤)。请问这种过滤方法其优点是____________________________________________________________。
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干个复分解反应,试写出其中任意一个反应的离子方程式________________________________________________________________________。
(2)加入凝聚剂可以除去其中的悬浮固体颗粒,该过程是________(填写下列各项的序号)。
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有化学过程又有物理过程
FeSO4·7H2O是常用的凝聚剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是________。
(3)通入二氧化碳的目的是________和________。
(4)气体A的作用是________。
(5)下列物质中,________可以作为气体A的代替品。(填写下列各项的序号)
①ClO2②浓氨水 ③SO2④浓硫酸
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作。回答下列问题:
(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是________________________________________________________________________。
(2)向溶液中加入适量的________溶液,使氯化钾转化为沉淀。
(3)将混合液进行过滤,过滤装置和操作如图,指出图中的两处错误:
①________________________________________________________________________;
②________________________________________________________________________。
(4)为了从滤液中得到硝酸钾晶体,可选用的两种方法是:
①________________________________________________________________________;
②________________________________________________________________________。
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。他们采用了以下操作制备胶体,请将空白处填写完整。
(1)取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1 mL~2 mL饱和________溶液,继续煮沸,待__________________后,停止加热。
(2)将制得的胶体放入半透膜制成的袋内,如图所示。放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察________(填“有”或“无”)丁达尔现象;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为____________。
(3)将半透膜内的液体倒入U形管中,如图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是____________(填“阴”或“阳”)极附近颜色逐渐变深,其原因是__________________________________。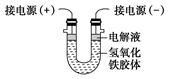
某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物: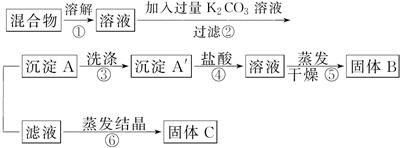
请回答下列问题:
(1)B物质的化学式为____________。
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步正确的方案应是____________。
(3)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是________的质量。