某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。他们采用了以下操作制备胶体,请将空白处填写完整。
(1)取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1 mL~2 mL饱和________溶液,继续煮沸,待__________________后,停止加热。
(2)将制得的胶体放入半透膜制成的袋内,如图所示。放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察________(填“有”或“无”)丁达尔现象;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为____________。
(3)将半透膜内的液体倒入U形管中,如图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是____________(填“阴”或“阳”)极附近颜色逐渐变深,其原因是__________________________________。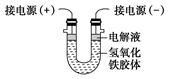
(12分)【化学一物质结构与性质】已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l。
(1)在第2周期中,第一电离能大于B的元素有____种。
(2)A的最简单气态氢化物分子的空间构型为________;H2B在乙醇中的溶解度大于H2C,其原因是_ ______。
(3)AB3,中,A原子轨道的杂化类型是_______ ,与AB3互为等电子体微粒的化学式
为________(写出一种即可)。
(4)D(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式_______.
(5)D2B的晶胞如图所示,已知晶体的密度为 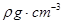 ,阿伏加德罗常数为
,阿伏加德罗常数为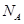 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含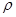 、
、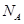 的式子表示)。
的式子表示)。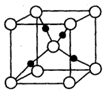
(10分)某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1;由②可知存在的离子为 ,浓度是 mol·L-1;由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
【选做题】本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。
若多做,则按A小题评分。
【改编】A.[物质结构与性质] 常见金属中钠、镁、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出基态Fe的核外电子排布式 。
(2)[Cu(NH3)2]+是一种常见的配合物
①与NH3互为等电子体的一种阳离子为 (填化学式)。
②[Cu(NH3)2]+中存在的化学键类型有 (填序号)。
A.配位键B.离子键
C.极性共价键 D.非极性共价键
③氨分子的空间构型为 (用文字描述)。
(3)FeCl3的熔点低易升华,而 MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是 。
(4)铜的化合物种类也很多,下图是铜的一种氯化物晶体的晶胞结构,则晶体的化学式为 。
(14)天然气是重要的化石燃料和工业原料,其主要成分为甲烷。
(1)CO2气体排放会产生温室效应,将通入CO2碳化了的水在如图1所示的电解池阴极区进行电解,可以直接产生甲烷,加入硫酸钠为了增加导电性。
①写出电解时阴极的电极反应式 。
②电解时电解池采用阳离子交换膜,若采用阴离子交换膜会对电解产生的影响为 。
(2)将甲烷和硫反应可以制备CS2,其流程如下:
①反应1产生两种含硫的物质,则该反应方程式为 。
②反应当中,每有1molCS2生成时,需要消耗O2的物质的量为 。
③为了将含硫化合物充分回收,实验时需对反应1出来的气体分流,则进入反应2和反应3的气体气体关系为 。
(3)甲烷在高温下分解生成烃和氢气,若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,甲烷在高温下分解反应的化学方程式为 。
A.【改编】[物质结构与性质]元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应:2XCl+2CO+2H2O=X2Cl2·2CO·2H2O
(1)X+基态核外电子排布式为 。
(2)C、N、O三种原子的第一电离能由大到小的顺序为 。
(3)X2Cl2·2CO·2H2O是一种配合物,与CO为互为等电子体的阴离子是 。
(4)新制的X(OH) 2悬浊液可以检验醛基,醛基中碳原子的轨道杂化类型是 ;1mol甲醛分子中含有ó的键的数目为 。
(5)XCl的晶胞如图所示,距离每个X+最近的Cl—的个数为 。