(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
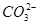 、 、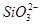 、 、 、Cl- 、Cl- |
| 阳离子 |
Al3+、Cu2+、Mg2+、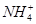 、Na+ 、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。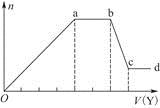
①若Y是盐酸,则溶液中含有的金属阳离子是____________________________,
ab段发生反应的总离子方程式为______________________________________,
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为
_________________________________________________________________。
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为____________________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:
___________________________________,________________________________。
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。
三氟化氮是一种无色、无味、无毒且不可燃的气体,但具有温室效应。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的反应方程式:.
(2)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为。
(3)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是和。
②T元素最可能是区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为,其中心原子的杂化方式为,该分子属于分子(填“极性”或“非极性”)。
写出下列反应的化学方程式:
(1)工业上用氮气和氢气合成氨:。
(2)金属铜与浓硝酸反应:。
(3)氢氧化铝与氢氧化钠溶液反应:。
(4)将二氧化硫气体通入氯水中:。
(5)碳酸氢钠受热分解:。
(6)苯与液溴在铁催化作用下反应:。
(7)酒精在空气中点燃:。
(8)溴乙烷与热的氢氧化钠水溶液反应:。
(9)苯酚与溴水反应:。
(10)将二氧化碳通入苯酚钠溶液中:。
经测定乙醇的化学式是C2H6O,由于有机物普遍存在同分异构现象,推测乙醇的结构可能是下列两种之一。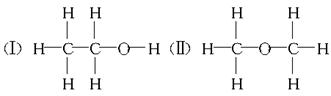
为测定其结构,应利用物质的特殊性进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙两位同学直接利用如图给定装置开始进行实验确定乙醇的结构。
(1)学生甲得到一组实验数据如上表:
| 乙醇的物质的量/mol |
氢气的体积/L |
| 0.10 |
1.12(标准状况) |
根据以上数据推断乙醇的结构为(用Ⅰ、Ⅱ表示),理由为
,
该反应的化学方程式为:。
(2)同学乙分别准确称量4.60 g乙醇进行多次实验,结果发现以排在量筒内水的体积作为生成的H2体积,换算成标准状况后都小于1.12L,如果忽略量筒本身及乙同学读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?(填“正确”或“不正确”)。请说明你判断的理由。
(3)实验后,两名同学从乙醇的可能结构分析入手,对乙醇和钠的量的关系进行了讨论,如果乙醇的物质的量为n mol,那么对钠的物质的量的取值要求必须是n(填“大于”、“小于”或“等于”)。
从樟科植物枝叶提取的精油中含有下列甲、乙两种成分: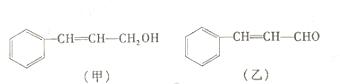
(1)甲中含氧官能团的名称为,乙中含氧官能团的名称为。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):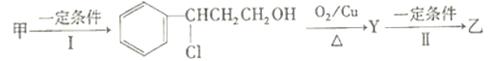
其中反应Ⅰ的反应类型为,反应Ⅱ的化学方程式为:
(注明反应条件)。
(1)在一定条件下制备氯乙烷(C2H5Cl),试回答:
①用乙烷制备氯乙烷的化学方程式是,
该反应的类型是。
②用乙烯制备氯乙烷的化学方程式是,
该反应的类型是。
比较上述两种方法,第种(填“①”或“②”)方法更好。
(2)聚乙烯塑料是由石油裂解产物乙烯通过加聚反应制得,写出乙烯反应生成聚乙烯的化学方程式。
该反应的类型是。