由环己烷可制得1, 4 – 环己二醇,下列有7步反应(其中无机产物都已略去),试回答:
(1) 反应 属于取代反应(填序号),反应⑦的反应类型 。
(2) 化合物的结构简式:B ,C ;
(3) 反应④所用试剂和条件是 ;
(4) 写出反应②、⑤的化学方程式:
反应②
反应⑤
【化学—选修2:化学与技术】
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
Ⅰ.氮的化合物是重要的化工产品。其生产方法也在逐渐改进中,各国科学家均在为提高其产量,降低能耗做各种有益的探究。
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g)==2NH3(g),ΔH="-92.4kJ/mol" 。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_________________________________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是;与传统的合成氨的方法比较,该方法的优点是。
Ⅱ.(3)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是。
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(4) 铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素。其反应原理为(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为:。
硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图: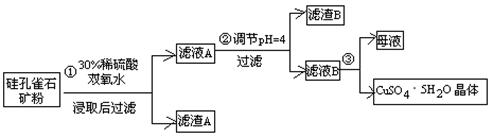
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A.CuOB. MgO C. FeCO3D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
由上表可知:当溶液pH=4时,不能完全除去的离子是________。
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3 饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。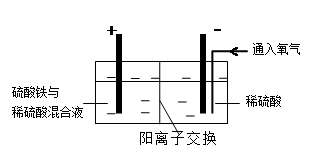
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是____。
(14分) Mg(ClO3)2常用作催熟剂、除草剂等,下图为制备少量Mg(ClO3)2·6H2O的方法: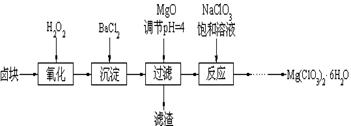
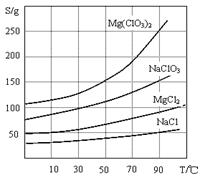
已知:1、卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
2、几种化合物的溶解度(S)随温度(T)变化曲线如上图。
(1)加入BaCl2的目的是除_________,如何判断该离子已除尽_____________________。
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3==Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;③;④冷却结晶;
⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL配好的溶液于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(3)写出步骤2中所发生反应的离子方程式。
(4)步骤3中若滴定前用标准液润洗滴定管,会导致最终结果(填“偏大”、“偏小”或“不变”)。
(5)产品中Mg(ClO3) 2·6H2O的质量分数为(计算结果保留两位小数) 。
[化学——选修5:有机化学基础]
已知有机物M中只含有C、H、O三种元素,其相对分子质量为88。与M有关的反应如下: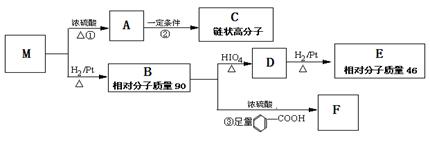
已知: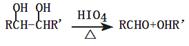
请按要求回答下列问题:
(1)M的分子式为_________,其分子中除碳氧双键外的官能团的名称为_______________。
(2)写出①、③的反应类型:①_______________________,③_______________________。
(3)E的名称___________,检验D中官能团的试剂是___________。
(4)写出反应②的化学方程式:____________________________________________;
(5)X是M的同分异构体,且X属于酯类,其结构简式有__________种,请写出只含一个
甲基的结构简式:__________________。
[化学——选修3:物质结构与性质]
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大, 其中A含有3个能级,且每个能级所含的电子数相同,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F除最外层原子轨道处于半充满状态,其余能层均充满电子,请回答下列问题:
(1)元素A、B、C的第一电离能由小到大的是_______(用元素符号表示)。
(2)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。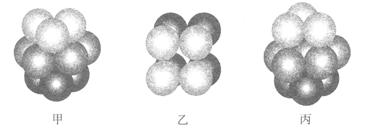
(3)B与C形成的四原子阴离子的立体构型为,其中B原子的杂化类型是。
(4)任写一种与AB-离子互为等电子体的离子。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式。
(6)D和E形成的化合物的晶胞结构如图,其化学式为,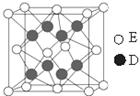
已知晶体的密度为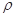 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,
则晶胞边长a=cm。(用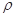 、NA的计算式表示)
、NA的计算式表示)
(7)A、B、C三种元素和氢元素形成的氰酸有两种结构,一种分子
内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,
且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写
出氰酸和异氰酸的结构式:_______________、______________。