(12分)
随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,用活性炭还原法处理氮氧化物是消除氮氧化物污染的有效方法。
⑴已知产物 A、B 都是参与大气循环的气体,请结合下表数据写出NO与活性炭反应的化学方程式:
⑵某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
时间/min |
NO |
A |
B |
||
| 0 |
0. 10 |
0 |
0 |
||
| 10 |
0.058 |
0.021 |
0.021 |
||
| 20 |
0.040 |
0.030 |
0.030 |
||
| 30 |
0.040 |
0.030 |
0.030 |
||
| 40 |
0.032 |
0. 034 |
0.017 |
||
| 50 |
0.032 |
0. 034 |
0.017 |
①T1℃时,求该反应平衡常数(列出K的表达式,要求计算过程)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、A、B的浓度之比为5:3:3,则该反应的△H 0(填“>”、“=”或“<”)。
④压缩容器体积,增大压强对该反应的反应速率和平衡移动的影响是 。
已知有关物质的熔沸点数据如下表:
| MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
| 熔点/℃ |
2852 |
2072 |
714 |
190 |
| 沸点/℃ |
3600 |
2980 |
1412 |
182.7 |
请参考上述数据填空和回答问题。
(1)工业上常用电解熔融MgCl2的方法生产金属镁,而不用电解电解MgO的方法生产镁。
(2)工业上用电解Al2O3与冰晶石熔融混合物的方法生产铝,而不用电解AlCl3的方法生产铝,冰晶石在炼铝过程中的作用是。
(1)炼钢和炼铁都利用氧化还原反应,但炼铁是有,其核心反应是。而炼钢主要是用,其除碳的反应为。
(2)炼铁时常用的焦炭形成还原剂,能用煤代替吗?,为什么?
(3)检查钢质设备完好性的方法之一是:在被怀疑有裂纹处涂上10%的盐酸,过一段时间如观察到有粗线裂纹,表明该部分原先确有裂纹,产生粗线裂纹的原因是
某种ABS工程树脂,由丙烯腈(CH2= CHCN,符号A)、1,3-丁二烯(符号B,CH2="CHCH=" CH2)和苯乙烯(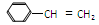 ,符号S),按一定配比共聚而得。
,符号S),按一定配比共聚而得。
(1)A、B和S 三种单体中,碳氢比(C﹕H)值最小的单体是。
(2)经元素分析知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是(用a、b、c)。
科学家把药物连接在高分子载体上制成缓释长效药剂。阿斯匹林结构为: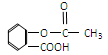 ;它可以连接在一高聚物载体上,形成缓释长效药剂,其中一种的结构简式为:
;它可以连接在一高聚物载体上,形成缓释长效药剂,其中一种的结构简式为: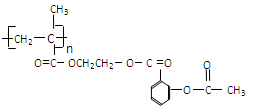
试回答:
(1)缓释长效阿司匹林的载体的结构简式为。
(2)服药后在人体内通过水解作用,可以缓慢地释放出阿司匹林,写出这个水解的化学方程式:。
(3)这种高分子载体是由单体发生聚合反应得到的。写出单体的结构简式。
Nomex纤维是一种新型的阻燃纤维。它可由间苯二甲酸和间苯二胺在一定重要条件下以等物质的量缩聚而成。请把Nomex纤维结构简式写在下面的横线上。
