CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图: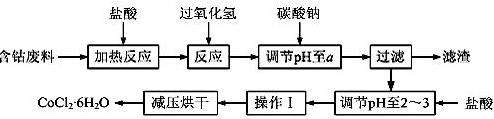
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为  。
。
(2)加入碳酸钠调节pH至a,a的范围是 ;
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (任写1点)。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
⑶过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道的电子排布有关。一般地,若为d0或d10排布时,无颜色;若为d1~d9排布时,有颜色;如[Cu(H2O)4]2+显蓝色。据此判断25号元素Mn形成的络合离子[Mn(H2O)6]2+_____(填“有”或“无”)颜色。
⑷H-C≡C-COOH分子内含有的σ键、π键的个数依次为_______________,其中碳原子的杂化方式为___________________。
⑸CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键的类型是______________。
⑹W元素的原子的M能层为全充满状态,且核外的未成对电子只有一个,W晶体中微粒的堆积方式是下图中(选填“甲”、“乙”或“丙”);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数)。


甲乙丙
一氧化碳是一种用途相当广泛的化工基础原料。
⑴利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)  Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
⑵金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下左图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
⑶下右图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。依次写出A、B两电极发生反应的电极反应式
__________________________________、___________________________________。

⑷已知:①CO(g)+2H2(g) CH3OH(g)△H=-90.7 kJ·mol-1
CH3OH(g)△H=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)△H=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)△H=-41.2 kJ·mol-1
CO2(g)+H2(g)△H=-41.2 kJ·mol-1
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=_______________。
CH3OCH3(g)+CO2(g)的△H=_______________。
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工原料。某研究小组用粗铜(含杂质Fe) 按下述流程制备氯化铜晶体(CuCl2·2H2O)。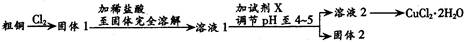
⑴实验室采用如右图所示的装置,可将粗铜与Cl2反应转化为固体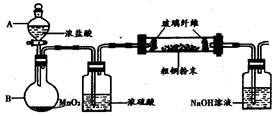
1(部分仪器和夹持装置已略去)。
①仪器A的名称是_________________。
②装置B中发生的反应的离子方程式是
__________________________________。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要______(填“是”或“否”)。
⑵试剂X用于调节pH以除去杂质,X可选用下列试剂中的_________(填序号)。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
⑶在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色,小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)
蓝色黄色
①上述反应的化学平衡常数表达式是K=________________________,若增大氯离子浓度,K值_________(填“增大”、 “减小”或“不变”)。
②取氯化铜晶体配制蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是___________(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
.鸡蛋壳中含有大量钙、少量镁和钾等元素。实验室可用图示流程测定鸡蛋壳中钙、镁元素含量。依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY。回答下列问题。
⑴测定Ca2+、Mg2+总含量时,控制溶液pH=10。若pH过大,测定结果将 (填“偏大”、“偏小”或“无影响”);
⑵测定Ca2+含量的关键是控制溶液的pH,使溶液中Mg2+形成沉淀,若要使溶液中c(Mg2+)不大于1.2×10-7mol/L,则溶液pH应不小于 (已知:Ksp[Mg(OH)2]=1.2×10-11,上述实验均在室温下进行)。
⑶如果鸡蛋壳粉质量为m g,溶液中Y2-浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是 。
⑷有同学提出可采用如下装置、通过测定鸡蛋壳与盐酸反应产生的二氧化碳的 量就能测定鸡蛋壳中的钙的总含量。
量就能测定鸡蛋壳中的钙的总含量。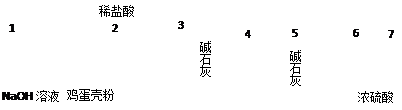




①采用该方法进行实验,各装置从左到右的连接顺序依次:
1—2—__ ______________ __(填各装置对应接口的数字序号)。
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?
|
答:________(填“准确”、“不一定准确”或“无法判断”)。
原因是___________________ __ 。
。
.1914年从猫薄荷植物中分离出来的荆芥内酯可用作安眠药、抗痉挛药、退热药等。通过荆芥内酯的氢化反应可以得到二氢荆芥内酯,后者是有效的驱虫剂。二氢荆芥内酯的合成路线如下: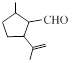
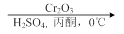 A
A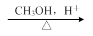
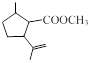
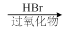 B
B 
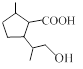

⑴请写出A的结构简式_________________________。
⑵请写出生成B物质的化学方程式_____________________________________________。
⑶以上合成路线中发生取代反应的有_______步。
⑷ 含有的含氧官能团是_____________。
含有的含氧官能团是_____________。
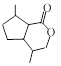
⑸满足以下条件的 的同分异构体有__________种。
的同分异构体有__________种。
⑹请写出由CH2=CHCH2CHO合成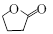 的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH
的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH CH2=CH2
CH2=CH2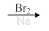 Br-CH2CH2-Br
Br-CH2CH2-Br