用18 mol/L 的浓硫酸配制100 ml 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解
④检漏 、转移、洗涤 ⑤定容、摇匀
、转移、洗涤 ⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (用下列编号填空)。
| A.10ml | B.25ml | C.50ml | D.100ml) |
(2)第③步实验的操作是
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线 ;改用 向容量瓶中滴加蒸馏水至 为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)检验试剂瓶中的溶液含有SO42-的操作是 
(5)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
①容量瓶用蒸馏水洗涤后残留有少量的水 ;
②所用过的烧杯、玻璃棒未洗涤 ;
③加水超过刻度线后,用胶头滴管吸出多余的液体 。
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。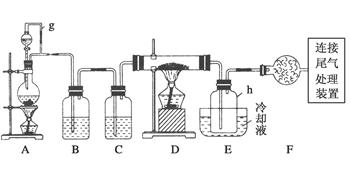
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
| 升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________________。
(2)装置A中g管的作用是________;装置C中的试剂是________;装置E中的h瓶需要冷却的理由是__________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(9分)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):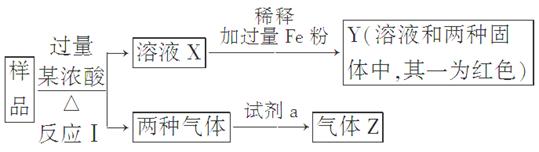
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是____________________________________________________________
________________________________________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)________。
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、N H4C1等物质
H4C1等物质 溶解度的差异,以食
溶解度的差异,以食 盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳
盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟 “侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳 酸钙;D:含氨的饱和食盐水、水
酸钙;D:含氨的饱和食盐水、水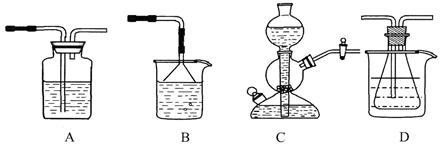
四种盐在不同温度下的溶解度(g/100g水)表
| 0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
| NaCl |
35.7 |
35.8 |
36.0 |
36_3 |
36.6 |
37.0 |
37.3 |
39.8 |
| NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
—① |
— |
— |
— |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
| NH4Cl |
29.4 |
33.3 |
37.2[ 来源:Z|xx|k.Com] 来源:Z|xx|k.Com] |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是(填字母)。
(2)A装置中盛放的试剂是,其作用是。
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体。用蒸馏水洗涤NaHCO3晶体的目的是除去杂质(以化学式表示)
( 5)将锥形瓶中的产物过滤后,所得的母液中含有(以化学式表示),加入氯化氢,并进行操作,使NaCl溶液循环使用,同时可回收NH4C1。
5)将锥形瓶中的产物过滤后,所得的母液中含有(以化学式表示),加入氯化氢,并进行操作,使NaCl溶液循环使用,同时可回收NH4C1。
(11分)某课外活动小组欲制取次氯酸钠和氯化钠的混合溶液,为提高次氯酸钠含量,采用如图所示装置。图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸。(据资料显示:Cl2与NaOH在不同温度下,产物不同。在较高温度下易生成NaClO3)
试回答:
(1)烧瓶B中盛________,试管C中盛________。
(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置________(填“能”或“不能”),理由是
________________________________________________________________________;
②能否省去丙装置________(填“能”或“不能”),理由是
_____________________________________________________________________________________。
(3)有同学认为还必须添加某些装置,你认为怎样?________(填“需要”或“不需要”),如果你认为需要,请指出该装置的作用是_______________________________________________。
(4)丁装置中冰水的作用是____________________________________________________________。
(9分)某无色待检溶液A中含有K+、Cl-、OH-、SO32-、SO42-,为检验确认其中所含的各阴离子,可选用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、高锰酸钾溶液和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如图所示。
(1)图中试剂①④⑤的化学式分别为:①________,④________,⑤________。
(2)图中现象a、b、c表明检验出的离子分别是:a.________,b.________,c.________。
(3)无色溶液A中加试剂③的主要目的是_____________________________________
________________________________________________________________________。
(4)把白色沉淀A中加入的试剂②改为试剂③对实验的影响是___________________
________________________________________________________________________。