下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液。各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):
(1)写出乙的化学式 、A的电子式 、甲在周期表中位置是 ;
(2)写出G的一种用途 ;
(3)写出B与K反应的化学方程式: ;
(4)整个转换过程中属于氧化还原反应的有 个;
(5)写出反应③E与G按物质的量之比2:1的反应的离子方程式 。
乙炔是有机合成工业的一种原料,工业上曾用CaC2与水反应制备乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为;1 mol O中含有的π键数目为。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH—C≡N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长,CaC2晶体中1个Ca2+周围距离最近的C22-数目为。
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。
回答下列问题:
(1)元素a为;c为;
(2)由这些元素形成的双原子分子为;
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线形的是,非直线形的是;(写2种)
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是;(每空填一种)
(5)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,该反应的化学方程式为。
2012年在全球市场需求增速减缓形势下,我国LED产业进入了行业格局重组和竞争模式转变的新阶段。目前市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如右图。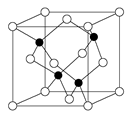
试回答:
(1)镓的基态原子的电子排布式是。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为,与同一个镓原子相连的砷原子构成的空间构型为。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是(用氢化物分子式表示)。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为。
(5)比较二者的第一电离能:AsGa(填“<”“>”或“=”)。
(6)下列说法正确的是(填字母)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.GaP与GaAs互为等电子体 |
| C.电负性:As>Ga |
| D.砷化镓晶体中含有配位键 |
Ⅰ.下列说法中正确的是。
| A.SO2和O3、PO43-和ClO4-互为等电子体 |
| B.甲烷分子失去一个H+,形成CH3-,其碳原子的杂化类型发生了改变 |
| C.Ti原子的核外电子排布式为[Ar]3d34s2 |
| D.CS2、H2O、C2H2都是直线形分子 |
E.CH4、BCl3、CO2都是含有极性键的非极性分子
Ⅱ.立方氮化硼是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐,比较下列原子的第一电离能:BeB,NO(填“>”“<”),其原因是。
(2)如图为立方氮化硼的晶胞,则氮化硼的化学式为,该晶体中B原子填充N原子的空隙。若该晶胞的边长为a cm,那么该晶体的密度为g/cm3(只要求列出算式)。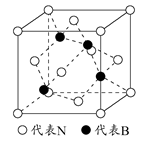
(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因:。
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为,请画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个)。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如图所示。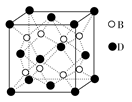
请回答:
(1)A元素的名称是。
(2)B的元素符号是,C的元素符号是,B与A形成的化合物比C与A形成的化合物沸点高,其原因是。
(3)E属元素周期表中第周期,第族的元素,其元素名称是,它的+2价离子的电子排布式为。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(只要求列出算式)。