现有3种化合物 A、B、C均含短周期元素R,其转化关系如下图所示。
A、B、C均含短周期元素R,其转化关系如下图所示。
(1)若A由第三周期2种元素组成。常温下,0.1mol/L X溶液的pH=13,则R在周期中的位置是______________。X中阴离子的电子式是_________,B转化为C的离子方程式是___________。
(2)若常温下A、B、C、X均为气态物质,1mol A中含有共价键的数目约为1.806×1024,X为单质,A与X反应生成B的化学方程式是_____________;在一定条件下,A可与C反应消除C对大气的污染,该反应的化学方程式是________________。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大_________________,原因是。
(2)哪一段时段的反应速率最小,原因是。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,直接写计算结果)。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)。
天然气是一种洁净环保的优质能源,天然气主要成分是烷烃,其中甲烷占绝大多数。
(1)甲烷分子具有____________结构,其结构式是___________。
(2)天然气是一种高效、低耗、污染小的清洁能源,已知1mol甲烷完全燃烧生成CO2气体和水蒸气放出802KJ热量,则在相同条件下,1mol甲烷完全燃烧生成CO2气体和液态水,放出的热量________802KJ(填“>”、“=”或“<”)。
(3)通常情况下,甲烷比较稳定,但在特定条件下,甲烷也会发生某些反应,请写出甲烷在光照条件下与氯气反应生成一氯甲烷的化学方程式__________________该反应属于______________(填反应类型)。
(4)在一定条件下甲烷也可用于燃料电池。下图是甲烷燃料电池的原理示意图: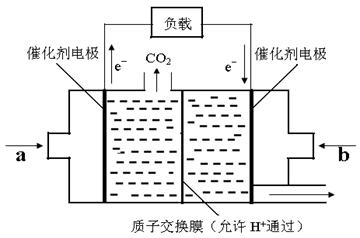
若正极的反应式为O2+4e-+4H+=2H2O,则负极反应式为___________________;该电池工作过程中,H+的移动方向为从_____到_____(填“左”或“右”)。
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 |
相对速率 |
| (CH3)2C=CHCH3 |
10.4 |
| CH3CH=CH2 |
2.03 |
| CH2=CH2 |
1.00 |
| CH2=CHBr |
0.04 |
下列化合物与溴加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是_______________(填序号);
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3C.CH2="CH" CH3 D.CH2=CHBr
(2)0.5mol某炔烃最多能与1molHCl发生加成反应得到氯代烃,生成的氯代烃最多能与3mol Cl2发生取代反应,生成只含C、Cl两种元素的化合物。则该烃的结构简式是;
(3)某芳香烃A,其相对分子质量为104,碳的质量分数为92.3%。
①A分子中可能共平面的碳原子最多有个;
②芳香烃A在一定条件下可生成加聚高分子,该高分子结构中的链节为;
③一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出形成该化合物的有机反应方程式;
④已知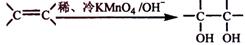 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式。
随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知常温下1mol丙烷燃烧放出2220kJ热量,1mol正丁烷燃烧放出2878kJ热量,1mol异丁烷燃烧放出2869.6kJ热量。试回答下列问题:
(1)表示正丁烷燃烧的热化学反应方程式;
(2)下列有关说法正确的是;
| A.奥运火炬燃烧时的能量转化主要是由化学能转变为热能 |
| B.相同条件下,正丁烷的热值比丙烷大 |
| C.正丁烷比异丁烷不稳定 |
| D.异丁烷分子中的碳氢键比正丁烷的多 |
(3)已知1mol H2燃烧生成液态水放出热量是285.8 kJ,现有5mol 氢气和丙烷的混合气体,完全燃烧时放热3847kJ,则氢气和丙烷的体积比为。